1. Giriş: Teşhis Laboratuvarları için Güvenlik Kültürü
Bu rapor, özellikle insan ve hayvan klinik tanı laboratuvarları için rehberlik sunar ve biyogüvenlik uygulamalarını önerir ve Ulusal Sağlık Enstitüleri (1) tarafından geliştirilen Mikrobiyolojik ve Biyomedikal Laboratuvarlarda Biyogüvenliğin (BBL-5) 5. baskısını tamamlamayı amaçlamaktadır. Bu belge, mevcut biyogüvenlik kılavuzlarının yerini almak için değil, 1) klinik tanı laboratuvarlarındaki faaliyetlerin güvenliğini artırmak, 2) laboratuvar çalışanlarını daha önce dikkate almamış veya ele almamış olabilecekleri güvenlik konuları hakkında düşünmeye teşvik etmek ve 3) laboratuvarları laboratuvarlarında bir güvenlik kültürü oluşturmaya ve teşvik etmeye teşvik etmek için yazılmıştır. Burada sağlanan kılavuzlardan herhangi biri federal, eyalet veya yerel yasalar veya düzenleyici gerekliliklerle çelişiyorsa, laboratuvar federal, eyalet veya yerel gereksinimlere uymalıdır. Bu güvenlik kültürü aynı zamanda Klinik ve Laboratuvar Standartları Enstitüsü (2) tarafından da desteklenmektedir. Bir teşhis laboratuvarında çalışmak, biyolojik bileşenin ötesinde güvenlik hususlarını gerektirir; bu nedenle, bu kılavuzlar aynı zamanda biyolojik güvenliğin ana odak noktası olduğu ortamlarda laboratuvarcıları etkileyen daha önemli günlük güvenlik sorunlarından birkaçını da ele almaktadır.
ABD'ye göre Çalışma İstatistikleri Bürosu, 2008 yılında Amerika Birleşik Devletleri'ndeki insan teşhis laboratuvarlarında yaklaşık 328.000 tıbbi laboratuvar teknisyeni ve teknolog çalıştı. Tüm mesleklerden yaklaşık 500.000 kişi insan ve hayvan teşhis laboratuvarlarında çalışıyor. Kronik tıbbi durumları olan veya immünsüpresif tedavi alan bu çalışanlardan herhangi biri, laboratuvar maruziyetinden sonra laboratuvar tarafından edinilmiş bir enfeksiyon (LAI) için yüksek risk altında olacaktır. Maruziyetten sonra enfeksiyon için kesin risk bilinmemektedir, çünkü kaynağı veya bulaşma modunu belirlemek genellikle zordur. Ulusal gözetim sistemi mevcut değildir.
LAI'ler ve maruziyetler 20. yüzyılın başlarından beri rapor edilmiştir, ancak yalnızca 1970'lerde riskin nicel değerlendirmelerini denemek için yeterli veri mevcuttu. Son MMWR raporları (3–11), bakterilerin enfeksiyonların >%40'ını oluşturduğunu ve LAI'lerde etiyolojik ajan olarak bildirilen >37 türün olduğunu göstermiştir; ancak, diğer mikroplar sıklıkla dahildir. Hepatit B, genel popülasyonun iki ila dört katı olan 1000 işçi başına 3,5-4,6 vaka oranıyla en sık laboratuvarda edinilen viral enfeksiyon olmuştur. Kan tüplerini toplayan veya işleyen herhangi bir laboratuvarcı savunmasızdır (12).
LAI'lerin ilk anketleri, laboratuvar personelinin Mycobacterium tuberculosis ile enfekte olma olasılığının genel popülasyondan üç ila dokuz kat daha fazla olduğunu buldu (13,14). 1986'da Amerika Birleşik Devletleri'nde 54 halk sağlığı ve 165 hastane laboratuvarında yaklaşık 4000 işçi ile yapılan bir ankette, hastane laboratuvarlarında 3.5/1000 çalışan enfeksiyonu ve halk sağlığı laboratuvarlarında 1.4/1000 çalışan enfeksiyonu meydana geldi (15). Birleşik Krallık'taki 397 klinik laboratuvardan 25.000 laboratuvar çalışanıyla 1994-1995 anketinde, genel LAI oranı 18/100.000 çalışandı (16).
ABD laboratuvarlarında bakteriyel menenjit üzerine 2005 CDC çalışmasında, Neisseria meningitidis önemli sayıda LAI'den oluştu. Bu organizmanın genel popülasyondaki saldırı oranı 13/100.000 kişiydi. 30-59 yaş arası genel popülasyonda (ortalama laboratuvarın tahmini yaş aralığı) saldırı oranı 100.000'de 0,3 idi. Mikrobiyologlar (30-59 yaş arası) için saldırı oranı 20/100.000 (17) idi.
LAI'ler ayrıca mantar ve paraziter enfeksiyonları da içermektedir. Laboratuvarda edinilen mantar enfeksiyonlarının en yaygın ajanları dimorfik mantarlar Blastomyces, Histoplasma ve Coccidioides'tir (18,19); bildirilen enfeksiyonların çoğu conidia'nın solunmasından kaynaklanmıştır. Bildirilen parazitle ilişkili LAI'lere öncelikle Leishmania, Plasmodium, Toxoplasma, Chagas hastalığı organizması ve diğer tripanozomlar neden olmuştur (20). Laboratuvarda edinilen 52 sıtma vakasının %56'sı vektör kaynaklıydı (klinik laboratuvarlarda değil, araştırmada kullanılan sivrisineklerden). Enfekte olmuş sağlık çalışanlarının çoğu, kan smearlarının hazırlanması sırasında veya kan alırken iğne çubuklarından enfeksiyon kaptı.
Klinik kimya laboratuvarlarında, 17 New York hastanesinden elde edilen veriler, en sık maruz kalma olarak iğne delinmesi (103 vaka), asit veya alkali dökülmeleri (46), cam kesimleri (44), göze sıçrama (19) ve morluklar ve kesikler (45) olarak listeledi (21). İğne delinmesi, cam kesikleri, göze sıçrama ve morluklar ve kesikler mikroplardan kaynaklanan enfeksiyon için en yüksek potansiyele sahiptir.
Hematoloji laboratuvarında, yaralanmaların başlıca nedenleri muhtemelen kan ve vücut sıvılarına maruz kalmaktır; iğne çubukları, santrifüjden aerosoller veya tüp tıpalarının çıkarılması, tüp kırılması; veya kontamine eldivenler (22). Tanı laboratuvarının mikrobiyoloji olmayan bölümlerinde, birincil hata, belirli bir numunenin bulaşıcı ajan içermediğini varsaymak ve daha sonra enfeksiyon riskine çok az dikkat ederek çalışmak olabilir. Bu senaryo, moleküler ve biyokimyasal teknolojiler gibi yeni teknolojiler geliştiren laboratuvarlarda ve biyogüvenlik hususları ve kişisel koruyucu ekipman gibi bariyer tekniklerinin kullanılmasını gerektiren testlere alışkın olmayan personel tarafından gerçekleştirilen bakım noktası teşhisinde özellikle sorunlu olabilir.
1.1. Yöntemler
LAI'lerin riskleri ve nedenleri belgelenmiştir. Bununla birlikte, biyogüvenliğe odaklanan kanıta dayalı araştırma ve yayın eksikliği vardır; özellikle eksik olan teşhis laboratuvarlarının günlük operasyonlarında güvenli uygulamaları belgeleyen çalışmalardır.
2008 yılında CDC, teşhis laboratuvarlarında laboratuvar biyogüvenliğini gözden geçirmek için çeşitli kurumlardan, laboratuvar organizasyonlarından ve tesislerden laboratuvar temsilcilerinden oluşan bir Mavi Kurdit Panel topladı. Panel üyeleri ya temsil ettikleri davet edilen ulusal laboratuvar organizasyonu tarafından seçildi ya da ulusal düzeyde biyogüvenlikteki rolleri nedeniyle CDC tarafından davet edildi. Panele katılan kuruluşlar, Amerika Birleşik Devletleri'ndeki laboratuvar teknoloji uzmanlarının çoğunluğunu temsil etti. Ayrıca, panelin bazı üyeleri biyogüvenlik camiasının temsilcileriydi. Mavi Kurdele Paneli, biyogüvenlik kılavuzlarının tanı laboratuvarı topluluğunun benzersiz operasyonel ihtiyaçlarını karşılamak için geliştirilmesini ve bunların bilime dayalı ve geniş çapta kullanıma sunulmasını tavsiye etti.
Panel üyeleri, yazma ekibi tarafından geliştirilen ve sentezlenen yönergeleri gözden geçirdi. Her temsilcinin tavsiyelerin yazılı onayını vermesi gerekmesine rağmen, temsil ettikleri kuruluşlar tarafından resmi onaylar gerekli değildi. Her katılımcıdan gelen düzenlemeler ve yorumlar dikkatlice değerlendirildi ve uygun olduğunda dahil edildi. Burada sağlanan kılavuzlar, tavsiyelerin yapılabileceği, ifade edilmesi gereken sağduyulu yaklaşımları ve güvenli prosedürlerin tanımlandığı ve kanıtlandığı yerlerde haklı çıkarılabileceği, kanıta dayalı verilerin hakemli yayınlarının sistematik incelemelerinden sentezlenir ve desteklenir. Biyogüvenlik uygulamalarıyla ilgili mevcut literatürün çoğunda kanıta dayalı araştırma eksikliği nedeniyle, kanıtları ve sonuçta ortaya çıkan önerileri (yani güçlü veya zayıf) ağırlıklandırmak için hiçbir girişimde bulunulmadı. Kanıta dayalı destekleyici araştırma ve dokümantasyonun yokluğunda, bazı öneriler mikrobiyoloji alanındaki uluslararası uzmanların uzman görüşüne dayanır ve kanıta dayalı araştırmalar geçerliliklerini kanıtlayana kadar uygun şekilde uygulanmalıdır. Yazarlar kendi bölümlerini gözden geçirip onayladılar ve ayrıca konularının tüm belgenin hedeflerini nasıl doğru bir şekilde yansıttığını ve desteklediğini değerlendirdiler.
Tavsiyelerin her bölümü, hem de üyeleri bu yönergeleri benimseyecek ilgili ulusal kuruluşlar tarafından gözden geçirildi. Bunlar arasında Amerikan Patologlar Koleji, Büyük New York Hastanesi Birliği Bölgesel Laboratuvar Görev Gücü, Amerikan Mikrobiyoloji Derneği, Amerikan Klinik Laboratuvar Derneği, Halk Sağlığı Laboratuvarları Derneği, Amerikan Klinik Laboratuvar Bilimi Derneği, Amerikan Klinik Patoloji Derneği, Amerikan Biyolojik Güvenlik Derneği, Amerikan Veteriner Laboratuvar Teşhiscileri Derneği ve bireysel doktorlar ve konu uzmanları yer aldı. Laboratuvardaki biyogüvenlik uygulamalarında gelecekteki araştırmalar, daha fazla tavsiyeye katkıda bulunacak ve diğerlerini kanıtlayacak ve bu belgeyi gözden geçirme fırsatları sağlayacaktır.
1.2. Risk
Klinik tanı laboratuvarlarında çalışan kişiler birçok riske maruz kalmaktadır (1). Hastalar ister insan ister hayvan olsun, ister laboratuvarcılar mikrobiyolojide ister laboratuvarın başka bir yerinde çalışsın, insan ve hayvan teşhis laboratuvarı zorlu bir ortamdır. Laboratuvarcılar önerilen, bilime dayalı güvenlik önlemlerinden ne kadar çok haberdar olur ve bunlara ne kadar bağlı kalırsa, risk o kadar düşük olur. Bir güvenlik programının amacı, hasta örnekleri ve canlı organizmalar manipüle edildiği sürece sıfır risk henüz ulaşılamasa da, riski mümkün olduğunca sıfıra indirmektir. Laboratuvarcıların, iş arkadaşlarının, hastaların, ailelerin ve çevrenin korunması en büyük güvenlik sorunudur.
1.3. Laboratuvar Maruziyetleri
Laboratuvar maruziyetleri genel olarak şüphelenilenden daha sık meydana gelir. Küçük sıyrıklar veya kesikler, önemsiz dökülmeler veya tanınmayan aerosoller gibi diğer laboratuvar olayları daha da sık meydana gelir ve bir LAI ile sonuçlanan bir maruziyete neden olmayabilir. Bu raporda, "laboratuvar maruziyetleri", çalışanları bir LAI için riske sokan olayları ve LAI'ların gerçek olarak edinilmesiyle sonuçlanan olayları ifade eder. Belirli, potansiyel olarak tehlikeli biyolojik ajanların ve toksinlerin ele alınmasıyla ilgilenen CDC'nin Select Agent Programı tarafından uygulanan raporlama gereklilikleri dışında, tıbbi laboratuvar maruziyetlerinin ve sonraki işle ilgili enfeksiyonların bildirildiği hiçbir ulusal gözetim sistemi mevcut değildir. Artan ilgi, 2001'den beri laboratuvar biyogüvenliği ve biyogüvenliğe odaklanmıştır, ancak büyük ölçüde biyoterörizm ajanları için gereken önlemlerle sınırlı kalmıştır. Diğer laboratuvar maruziyetleri ve LAI'ler, neredeyse her zaman yerleşik güvenlik protokollerinin bozulması nedeniyle oluşmaya devam ediyor. LAI'leri bildirmek için resmi bir gözetim mekanizmasının olmaması ve yaralanmalar bildirilirse bir gözetim kurumu tarafından cezai eylem korkusu nedeniyle, LAI'lerin kapsamını ve nedenini belirlemek için gereken veriler mevcut değildir. Ayrıca, LAI'lerin önlenmesi konusunda bilime dayalı içgörü eksikliği vardır.
Mavi Kurdele Paneli, Amerika Birleşik Devletleri'nde anonimlik potansiyeli olan gönüllü, cezai olmayan bir gözetim ve raporlama sistemine duyulan ihtiyacı kabul eder. Böyle bir sistem, tüm LAI'ların raporlanmasına ve değerlendirilmesine izin verecek ve potansiyel olarak ihmal edilebilir bir insidans oranını kolaylaştırmak için eğitim ve müdahalelere yol açacaktır.
1.4. Laboratuvar Enfeksiyon Yolları
LAI'lerin en baskın beş rotası
- şırınga iğneleri veya diğer kontamine keskin uçlarla parenteral aşılamalar;
- cilt ve mukoza zarlarına dökülür ve sıçrar;
- ağız pipetleme yoluyla yutma veya maruz kalma veya parmaklarla veya kontamine nesnelerle ağız veya gözlere dokunma;
- hayvan ısırıkları ve çizikleri (araştırma laboratuvarları veya faaliyetleri); ve
- bulaşıcı aerosollerin solunması (1).
İlk dört yolun tespiti nispeten kolaydır, ancak bildirilen tüm LAI'ların <%20'sini oluştururlar (23,24). 1978'den (24–26) önce bildirilen LAI'ların yaklaşık %80'inde ayırt edilebilir maruz kalma olayı tanımlanmamıştır. Çoğu durumda, tek ilişki, enfekte olmuş kişinin mikrobiyolojik bir ajanla çalışması veya mikrobiyolojik bir ajanı işleyen bir kişinin yakınında olmasıydı. Belirli bir olayı tanımlayamama, vakaların sadece %50'sinde olası LAI kaynaklarının belirgin olduğunu bulan daha yeni bir çalışmada (27) da bildirilmiştir. Bu veriler, beklenmeyen bulaşıcı aerosollerin LAI'lerde büyük rol oynayabileceğini düşündürmektedir (1,23,24,28).
1.5. Bir Güvenlik Kültürü
Bu raporda açıklandığı gibi bir "güvenlik kültürü" kavramı, tüm insan ve hayvan teşhis laboratuvarlarını, ilgili riskleri belirlemek ve bu riskleri azaltmak için planlar uygulamak için tüm iş süreçlerinin ve prosedürlerinin sistematik olarak değerlendirildiği bir organizasyon kültürünü teşvik etmeye teşvik eder. Teşhis örneklerinin işlenmesiyle ilişkili çoğu zaman bilinmeyen biyolojik tehlike riskine ek olarak, teşhis laboratuvarının her bir bölümü, maruz kalma ve olası enfeksiyon ve/veya mesleki yaralanma için aşırı risk taşıyan bilinen bulaşıcı ajanları işlemek için prosedürlere ve süreçlere sahiptir. Bu riskler tipik olarak tasarım kusurları veya güvenlik prosedürlerinin ve eğitimin eksikliği veya yetersizliği ile ilişkilidir (1,2). Buna ek olarak, bir insan veya hayvan teşhis laboratuvarının günlük operasyonları, bir akademik veya araştırma laboratuvarınınkinden önemli ölçüde farklıdır ve farklı biyogüvenlik kılavuzları gerektirir; bu farklılıklar, bu raporun tıbbi laboratuvar toplulukları, mesleki riskleri, maruz kalma potansiyeli ve bu riskleri azaltma fırsatları üzerine odaklanmasını sağladı.
Bir güvenlik kültürünün başarılı bir şekilde kurulması, laboratuvar güvenliğinin organizasyon için ayrılmaz ve görünür bir öncelik haline gelmesini, her şeyden önce üst yönetim tarafından ve çalışanları arasında güvenli davranışları teşvik etmek için gereken eşlik eden altyapı desteği ile benimsenmesini gerektirir (29–31). Klinik Laboratuvar İyileştirme Değişiklikleri, Amerikan Patologları Koleji ve diğer akreditasyon kurumlarının gerektirdiği gibi, bir laboratuvar direktörünün
- laboratuvar içinde bir güvenlik kültürü için bir politika oluşturmak ve uygulamak;
- mümkün olduğunca çok sayıda tehlikeyi belirlemek ve bu tehlikeleri en aza indirecek veya ortadan kaldıracak uygulamaları ve prosedürleri belirlemek;
- tüm personelin talimat verilmesini ve risk değerlendirmeleri yapmakla meşgul edilmesini sağlamak ve bireysel çalışma ortamlarındaki laboratuvar tehlikelerini tanımlayabileceklerini göstermek;
- tüm personelin, belirlenen işyeri tehlikelerini en aza indiren standart uygulama ve teknikler konusunda eğitimli ve yetkin olmasını sağlamak;
- personelin tehlikeleri tanımlaması ve yönetime risk azaltma stratejileri sunması için bir yol sağlamak; ve
- klinisyenleri ve hemşireleri, güvenliklerini ve klinik örnekleri alan laboratuvar personelinin güvenliğini sağlamak için güvenli numune tedariki ve nakliyesi konusunda eğitmek.
1.6. Mikrobiyoloji için Laboratuvar Tasarımı ve Mimari Planlama
Laboratuvar tasarımı, laboratuvar çalışanlarının, hastane personelinin ve hastaların güvenliği için esastır. Klinik ve Laboratuvar Standartları Enstitüsü belgesi, Laboratuvar Tasarımı; Onaylı Kılavuz (32), laboratuvar tasarımını ayrıntılı olarak tartışır. Kötü tasarlanmış laboratuvar çalışma alanını iyileştirmek zor, hatta imkansız olduğundan, tasarım dikkatli bir şekilde planlamayı ve güvenlik sorunlarının dikkate alınmasını garanti eder. Aşağıdakiler, teşhis laboratuvarının tasarımında veya yenilenmesinde dikkate alınması gereken önerilerdir. Laboratuvarda çalışan kişi başına bir alan için ulusal standart bir gereklilik olmamasına rağmen, bir laboratuvar departmanı içindeki 300–350 fit kare/kişi, güvenli bir çalışma alanı sağlamak için makul bir rakamdır. İdeal olarak, makul manevra kabiliyeti sağlamak için işçi (laboratuvar koltuğunda) ile işçinin arkasındaki herhangi bir nesne arasında minimum 5 fitlik bir boşluk bırakın.
- Mikrobiyoloji laboratuvarı için tasarım seçenekleri, diğer laboratuvar bölümlerinden kapatılabilir kapılarla ayrılmış, genel laboratuvarın kapalı bir bileşenini içermelidir. Gerekli olmasa da, yeni inşa edilen teşhis laboratuvarlarında ana laboratuvardan mikrobiyoloji laboratuvarına yönlü içe hava akışı da önerilmektedir. Tesis açık bir tasarımsa ve asma tavanı yoksa, mikrobiyoloji laboratuvarı, açıklık görünümü veren ancak olası aerosol maruziyetlerine karşı tabandan tavana güvenlik bariyeri sağlayan şeffaf cam veya Pleksiglas duvarlara sahip olabilir. Bir asma tavan yerindeyse, alanı kapatmak için şeffaf duvarın güverteye tavanın ötesine nüfuz etmesi gerekir. Yönlü oda havası olmayan önceden inşa edilmiş bir laboratuvarda, biyolojik güvenlik kabinlerinin (BSC'ler) sürekli çalışması, potansiyel aerosollere bir yön vermeye teşvik edilir.
- Yönlü hava, daha yüksek riskli laboratuvar prosedürlerinin yürütüldüğü çalışma alanlarına doğru artan negatif basınçla devam eden çevreleme bölgeleri sağlamaya teşvik edilir. Mikrobiyoloji laboratuvarı takımı içindeki hava işleme sistemleri, koridordan mikrobiyoloji laboratuvarına ve genel mikrobiyoloji laboratuvarından ayrı ve kapalı tüberküloz, mikoloji ve viroloji uzmanlık laboratuvarlarına yönlü hava akışı ile ayarlanabilmeli ve dengelenebilmelidir.
- Mikrobiyoloji laboratuvarları için, süpervizör ve laboratuvar direktörünün, bir biyogüvenlik uzmanıyla birlikte, yeni bir laboratuvar tesisinin özel ihtiyaçları ile ilgili girdi sağlaması kritik öneme sahiptir. Mikrobiyoloji bölümüne erişim yalnızca personelle sınırlandırılmalıdır. Mikrobiyoloji bölümünün bir dekontaminasyon tesisine sahip olması veya tıbbi atık sözleşmesinin olması ve el yıkama için bir lavabo sağlaması gerekir. Biyogüvenlik seviyesi (BSL)-3 tesisleri için eller serbest lavabolar (ayak pedalı ile çalıştırılır) gereklidir ve BSL-2 tesisleri için önerilir. Bench-tops geçirimsiz malzemelerden yapılmalıdır; laminat malzemeler delamine olabilir ve dezenfekte edilmesi zorlaşabilir. Dışarıya havalanan BSC'ler için, filtrasyondan sonra havanın dışarıya havalandırılmasını ve dış havalandırmaların tesisin hava giriş ünitelerinden uzağa yerleştirilmesini sağlamak için hava işleme dikkatlice planlanmalıdır. Birden fazla BSC sınıfı içeren laboratuvarlar için, belirli bir ünite içinde manipüle edilmesine izin verilen tehlikelerin personele açıkça (etiketle) belirtilmesi gerekir (1). Genel insan ve hayvan mikrobiyoloji laboratuvarı BSL-2 olmalıdır.
- BSL-3 tesisi mevcut değilse, bir risk değerlendirmesi yapılması koşuluyla, bazı ajanlar için BSL-2 artı negatif hava akışı ve solunum önlemlerinin kullanımı kullanılabilir.
- İnsan laboratuvarları için, tanımlama ve karakterizasyon için kültürleri manipüle eden ayrı tüberküloz ve viroloji laboratuvarları ideal olarak BSL-3 gereksinimlerini karşılayacaktır. Çoğu manipüle edilen virüsün insan patojeni olmadığı hayvan tanı virolojisi laboratuvarları için, bir risk analizi, bir numunedeki bir ajanın BSL-3'e ihtiyaç duyma olasılığının yüksek olduğunu göstermediği sürece uygulama BSL-2 gereksinimlerini karşılamaktır. Her laboratuvarda karşılaşılan spesifik risklerin dikkate alınmasını içerecek şekilde her tesiste risk değerlendirmeleri yapılmalıdır.
- Mikrobiyoloji laboratuvarlarındaki alıcı ve kurulum alanları, beklenen en fazla sayıda numuneyi barındıracak yeterli alanla tasarlanmalıdır. Bu alanda Sınıf IIA2 BSC, el yıkama için bir lavabo ve acil bir göz yıkama istasyonu gerekiyor. Telefon jakları, bilgisayar jakları ve elektrik prizleri, kurulum personelinin kolay erişimini sağlamak için bir veya iki yan yana cam ön buzdolabı veya bir çift buzdolabı için buzdolabı alanı ile birlikte modüle (kablosuz teknolojilerin kullanımı, her modülde telefon veya bilgisayar kablolama ihtiyacını azaltabilir) yerleştirilmelidir.
- Genel laboratuvar, her istasyonda bir bilgisayar için yeterli alanla tasarlanmış oturma çalışma alanları içermelidir. Tezgahın ortasının üzerinde depolama rafları olan çalışma tezgahları tercih edilebilir; bunlar çalışma alanını karıştırmadan malzemeler için alan sağlayacaktır. Depolama rafları, kimyasalların raftan kaymamasını sağlamak için 1 cm'lik (1/2 inç) bir dudağa ihtiyaç duyar. Çalışma alanını aydınlatmak için en iyi raf altı aydınlatmadır. Kolaylık sağlamak için, telefon ve bilgisayar jakları ile birlikte her iş istasyonunda elektrik prizleri önerilir. Gaz brülörleri artık evrensel olarak tavsiye edilmiyor.
- Mümkünse, karbondioksit ve anaerobik gaz tanklarını gerçek laboratuvarın dışına (tercihen korumalı ve hatta binanın duvarlarının dışına monte edilmiş) yerleştirin. Tankları laboratuvarın veya binanın dışına kilitli bir alana yerleştirilmesi, tank değişimi için kolay erişim sağlayacaktır. Uygun olduğunda, gaz tanklarını laboratuvarın belirli alanlarına bağlayan hatlar, gerekirse gelecekte taşınmaya izin vermek için sentetik borudan yapılmalıdır. Alarmlar kurulamadığı sürece, göstergelerin laboratuvarda günlük olarak okunması için kolaylıkların yapılması gerekir. Gaz depoları ayrı ayrı sabitlenmelidir (29).
- Atıklar bertaraf edilmeden önce yerinde dekontamine edilecekse, laboratuvarın ihtiyaçlarını karşılayacak kadar büyük bir otoklavı olmalıdır. Otoklavı iyi havalandırılan bir alanda bulun veya üzerindeki bir yakalama başlığından geçtiğinden emin olun. İdeal olarak, mikobakteriyoloji laboratuvarının kendi otoklavı olacaktır. Çift kapılı otoklavlar, bir tarafı mikobakteriyoloji laboratuvarına, diğer tarafı laboratuvar tarafından diğer atıkların bertaraf edilmesi için kullanılan bir bertaraf alanına açılacak şekilde kurulabilir. Düzenli bir bakım ve kalite güvence programına ek olarak, öngörülen yüklerin etkili bir şekilde dekontaminasyonu için otoklav döngülerinin validasyonu önerilmektedir.
- Optimal olarak, teşhis laboratuvarı — ana laboratuvardan, yani diğer laboratuvar disiplinlerinden kapatılabilen genel bir mikrobiyoloji laboratuvar alanı; — ayrı mikobakteriyoloji, viroloji ve mikoloji odaları (Sınıf IIA2 BSC ile genel laboratuvara göre negatif basınç altında) telefon ve bilgisayar jakları ile; — kalite kontrol testi, malzeme alınması ve kayıt depolama için yeterli alan veya ayrı odalar; ve — moleküler veya viroloji testi gibi daha fazla hizmet sunmak için gelecekte genişleme için ekstra bir oda. Sınıf IIA2 BSC, yönlü hava akışı, telefon jakları ve interkom gibi iletişim cihazlarını barındıracak şekilde odanın yenilenmesi gerekebilir. Bu tür odalarda telefon krikoları ve iletişim cihazları olmalıdır.
- Mevcut ve gelecekteki mikrobiyoloji alanının yeterli sayıda kan kültürü cihazı, otomatik tanımlama aletleri, otomatik enzim immünoassayları, nükleik asit ekstraksiyon ve test platformları ve pipetleme aletleri için tasarlandığından emin olun; buzdolapları; otomatik Gram boyayıcılar; otomatik plaka streakerler; BSC'ler; dondurucular; ve isteğe bağlı kullanım için ek bilgisayar istasyonları. Bazı tanımlama cihazları, ünite, yazıcı ve modüller için en az 8 fit ayak izi alanı gerektirir. Laboratuvar hizmeti sağlayacaksa, yaklaşık 6 fit ayak izi olan orta büyüklükte bir anaerop odası planlamalıdır. Risk değerlendirmeleri, muhafaza ventilasyonunun önerilip önerilmediğini belirlemek için otomatik prosedürel ekipman tarafından üretilebilecek bulaşıcı aerosollerin değerlendirilmesini içermelidir.
- Laboratuvarda kurul sertifikalı laboratuvar uzmanlarının mevcudiyeti, yüksek eğitimli, kurul sertifikalı tıp uzmanları ve cerrahlar kadar tıbbi bir tesis için önemlidir. Hasta bakımına rehberlik etmek için laboratuvar sonuçları kullanılıyorsa, hastalar daha azını hak etmiyor. Ek olarak, Amerikan Tıbbi Mikrobiyoloji Kurulu veya Amerikan Tıbbi Laboratuvar İmmünolojisi Kurulu'ndan diplomatlar veya liderlik pozisyonlarındaki eşdeğer uzmanlar, mikropları alan ve manipüle eden laboratuvarlar için değerli varlıklardır. Becerilerini laboratuvar direktörü veya danışman olarak kullanmak paha biçilmezdir ve şiddetle tavsiye edilir. Ayrıca, özellikle yorumlayıcı yargının örnek analizi için kritik olduğu ve nihayetinde hasta bakımını ve sonucunu doğrudan etkilediği mikrobiyolojide teknoloji uzmanları işe alınmalı ve tutulmalıdır.
2. Biyolojik Risk Değerlendirmesi ve Biyogüvenlik Kılavuzları
2.1. Risk Değerlendirmesi
Laboratuvar direktörü, potansiyel tehlikeleri belirlemekten, bu tehlikelerle ilişkili riskleri değerlendirmekten ve çalışanların bu risklere maruz kalmasını en aza indirmek için önlemler ve standart prosedürler oluşturmaktan nihai olarak sorumludur. Enfeksiyöz bir ajanın kimliği başlangıçta klinik laboratuvarda bilinmediğinden, genel öneri, Mikrobiyolojik ve Biyomedikal Laboratuvarlarda Biyogüvenlikte biyogüvenlik seviyesi (BSL)-2 standardı ve özel uygulamaların, klinik laboratuvardaki tüm çalışmalar için 5. baskının (1) takip edilmesi ve Mesleki Güvenlik ve Sağlık İdaresi'nin (OSHA'nın) Standart Önlemleri (eldivenler, önlükler ve koruyucu gözlükler) (33) ve BSL-2 uygulamalarının (2) tüm kan ve vücut sıvılarının kullanımı sırasında kullanılmasıdır. Diğer kapsamlı kaynaklar mevcuttur (34,35). Risk değerlendirmesi, burada ve Bölüm 12'de belirtildiği gibi, BSL uygulamalarının veya tesislerinin azaltılmasının veya artırılmasının garanti edildiğini belirleyebilir (Şekil 1).
Nitel biyolojik risk değerlendirmesi, profesyonel yargıları içeren öznel bir süreçtir. Belirsizlikler veya yetersiz bilimsel veriler nedeniyle, risk değerlendirmeleri genellikle eksik bilgi veya bilgiye dayanır. Süreçte yapılan içsel sınırlamalar ve varsayımlar da mevcuttur ve kabul edilebilir risk algısı herkes için farklılık gösterir. Risk asla sıfır değildir ve insan hatası potansiyeli her zaman vardır.
Laboratuvardaki potansiyel tehlikelerin belirlenmesi, risk değerlendirmesinin gerçekleştirilmesinde ilk adımdır. Bir numunenin toplandığı andan kalıcı olarak atılıncaya kadar birçok mikrobiyolojik tehlike kategorisine rastlanır. Laboratuvardaki tehlikeleri tanımlamak için kapsamlı bir yaklaşım, çeşitli kaynaklardan gelen bilgileri içerecektir. Tehlike bilgilerini tespit etme yöntemleri arasında kıyaslama, görüşmeler, ayrıntılı denetimler, olay incelemeleri, iş akışı ve süreç analizi ve tesis tasarımı yer alabilir.
Bir risk değerlendirmesi yapmak için tek bir standart yaklaşım veya doğru yöntem yoktur; ancak, bir risk önceliklendirme matrisi kullanmak, bir iş tehlikesi analizi yapmak veya bir prosedür, görev veya faaliyet sırasındaki potansiyel sorun senaryolarını listelemek gibi çeşitli stratejiler mevcuttur. Süreç aşağıdaki beş adımı içerir:
Bir kurumda risk değerlendirme sürecinin standardizasyonu, bu sürecin netliğini ve kalitesini büyük ölçüde artırabilir. Bu hedeflere ulaşmak için risk değerlendirmesinde personel eğitimi kritik öneme sahiptir.
2.1.1. Adım 1. Enfeksiyöz bir ajan veya materyalle ilişkili tehlikeleri tanımlayın.
- En yaygın bulaşma yolları tarafından belirlenen enfeksiyon potansiyeli (yani, yüzeylerden/fomitlerden ellere ve ağza kontaminasyon yoluyla yutma; kesiklerden, iğne çubuklarından, sağlam olmayan deriden veya ısırıklardan perkütan aşılama; mukoza zarlarıyla doğrudan temas; ve aerosollerin solunması) (Tablo 1);
- Numune tipi, hasta verileri (bireysel veya hastane popülasyonu), epidemiyolojik veriler ve numunenin coğrafi kökeni ile belirlenen rutin olarak izole edilen organizmaların sıklığı ve konsantrasyonu;
- İçsel faktörler (ajan biliniyorsa)
— Patojenite, virülans ve suş enfektifliği/iletişebilirlik;
— Bulaşma modu (laboratuvar iletim modu doğal iletimden farklı olabilir);
— Enfeksiyöz doz (enfeksiyonu başlatmak için gereken mikroorganizmaların sayısı, spesifik organizmaya, hastaya ve maruz kalma yoluna göre büyük ölçüde değişebilir);
— Ajanın formu (aşaması) (örn. hücre duvarının varlığı veya yokluğu, spora karşı bitki örtüsü, mikotik ajanlar için conidia'ya karşı hifler);
— Ajanın istilacılığı (belirli enzimleri üretme yeteneği); ve
— Antibiyotiklere karşı direnç. - Biyolojik güvenlik kabininde (BSC) çalışmanın devamını gerektirebilecek olası yüksek riskli patojenlerin göstergeleri, örneğin
— Gram-negatif çubuklar veya gram-negatif coccobacilli gösteren Gram lekesi ile 24-48 saatte yavaş yavaş büyüyen, küçük koloniler;
— Kan kültürü şişelerinde yavaş büyüme (yani, ≥48 saatte pozitif), Gram lekesi küçük gram-negatif çubuklar veya gram-negatif coccobacilli gösterir;
— Sadece çikolata agarında büyüme;
— Virgül çıkıntıları ve ground-glass görünümü ile düz, pigmentsiz, düzensiz kolonilerin hızlı büyümesi;
— Sporlu veya sporsuz boxcar- şekilli, gram-pozitif çubukları gösteren gram leke.
2.1.2. Adım 2. Ajana veya malzemeye maruz kalmaya neden olabilecek faaliyetleri belirleyin.
- Tesis (örneğin, BSL-2, BSL-3, açık kat planı [daha fazla risk] karşı belirli faaliyetler için ayrı alanlara veya odalara karşı [daha az risk], yeterli alan ve kalabalık alan, iş akışı, mevcut ekipman);
- Ekipman (örneğin, sertifikasız BSC'ler, çatlamış santrifüj tüpleri, uygun olmayan bakımlı otoklavlar, aşırı doldurulmuş kesici kaplar, Bunsen brülörler durumunda);
- Aerosol ve damlacık üretme potansiyeli.
Aerosoller çoğu rutin laboratuvar prosedüründen üretilebilir, ancak çoğu zaman tespit edilemez. Aşağıdaki prosedürler bulaşıcı aerosollerin oluşumu ile ilişkilendirilmiştir.
— İğneleri, şırıngaları ve kesici aletleri manipüle etmek-
Pozitif kan kültürü şişelerini alt kültürlendirmek, smear yapmak
-
Tüplerden veya şişelerden hava atmak
-
İğneleri tıpalardan çekme
-
İğneleri şırıngalardan ayırma
-
Vücut sıvılarını aspire etmek ve aktarmak
-
Hasat dokuları
-
Alevli döngüler
-
Kültür ortamında soğutma döngüleri
-
Alt kültür ve çizgi kültürü medyası
-
Bir pipetten son damlayı çıkarmak (Eppendorff pipetleri dahil)
-
Santrifüj
-
Kültürleri kurmak, medyayı aşılamak
-
Karıştırma, karıştırma, öğütme, çalkalama, sonikasyon ve vordaç oluşturma örnekleri veya kültürler
-
Sıvı numuneleri dökmek, bölmek veya boşaltmak
-
Kültür kaplarından kapakları veya sürüntüleri çıkarmak, liyofilize kültürleri açmak, kriyotüpleri açmak
-
Bulaşıcı maddenin deşmesi
-
Numuneleri vakum altında filtreleme
-
Otomatik tanımlama/duyarlılık testi için izolatların hazırlanması
-
Smear hazırlamak, ısı sabitleme yapmak, slaytları boyamak
-
Katalaz testi gerçekleştirme
-
Seroloji, hızlı antijen testleri, ıslak hazırlıklar ve slayt aglütinasyonları yapmak
-
Kirlenmiş maddeleri biyolojik olarak tehlikeli atıklara atmak
-
Dökülmeleri temizlemek
-
- Hayvanların kullanımı;
- Keskin uçların kullanımı;
- Büyük hacimlerde veya potansiyel patojen konsantrasyonlarında üretim;
- Yanlış kullanılan veya bakımı yapılan ekipman;
Olası tehlikelere örnek olarak, eldiven giyen işçiler için el becerisinin veya tepki süresinin azalması, N95 solunum cihazı takarken nefes alma yeteneğinin azalması veya kişisel koruyucu ekipmanın (PPE) uygun şekilde takılmamasıdır. - Laboratuvarda tek başına çalışmak.
Laboratuvarda tek başına çalışan bir kişi için doğal bir biyolojik tehlike yoktur; ancak, süpervizör bir kişinin tek başına çalışmak üzere görevlendirilip atanmadığını ve ne zaman görevlendirildiğini bilmekten sorumludur. Bir kişiyi tek başına çalışmak üzere atamak tesise özgü bir karar olduğundan, iş türü, fiziksel güvenlik, laboratuvar güvenliği, acil durum müdahalesi, potansiyel maruz kalma veya yaralanma ve diğer laboratuvara özgü konular dahil olmak üzere tüm güvenlik hususlarını açıklayan bir risk değerlendirmesi yapılmalıdır.
2.1.3. Adım 3. Laboratuvar personelinin yetkinliklerini ve deneyimlerini göz önünde bulundurun.
- Yaş (genç veya deneyimsiz çalışanlar daha yüksek risk altında olabilir);
- Genetik yatkınlık ve beslenme eksiklikleri, bağışıklık/tıbbi durum (örneğin, altta yatan hastalık, immünsüpresif ilaçların alınması, kronik solunum koşulları, hamilelik, bozulmamış cilt, alerjiler, el becerisi veya reaksiyon süresini azalttığı bilinen ilaçların alınması);
- Eğitim, öğretim, deneyim, yetkinlik;
- Stres, yorgunluk, zihinsel durum, aşırı iş yükü;
- Algı, tutum, güvenlik önlemlerine bağlılık; ve
- En yaygın maruz kalma veya vücuda giriş yolları (yani cilt, mukoza, akciğerler ve ağız) (Tablo 1).
2.1.4. Adım 4. Riskleri değerlendirin ve önceliklendirin.
Riskler, ortaya çıkma olasılığına ve sonuçların ciddiyetine göre değerlendirilir (Tablo 2).
- Oluşma olasılığı
— Neredeyse kesin: gerçekleşmesi bekleniyor
— Muhtemelen: bir ara olabilir
— Ilımlı: olabilir ama olası değil
— Olası değil: olabilir ama nadir
— Nadir: olabilir, ama muhtemelen asla olmayacak - Sonuçların şiddeti
Sonuçlar maruz kalma süresine ve sıklığına, aşının mevcudiyetine ve uygun tedaviye bağlı olabilir. Aşağıda bireysel çalışanlar için sonuç örnekleri verilmiştir.
— Taşıyıcı duruma giden kolonizasyon
— Asemptomatik enfeksiyon
— Toksisite, onkojenite, alerjenite
— Enfeksiyon, akut veya kronik
— Hastalık, tıbbi tedavi
— Hastalık ve sekeller
— Ölüm
2.1.5. Adım 5. Maruz kalma riskini en aza indirmek için kontrolleri geliştirin, uygulayın ve değerlendirin.
- Mühendislik kontrolleri
Mümkünse, önce izole edin ve tehlikeyi kaynağında bulun.
— Birincil muhafaza: BSC, kesici kaplar, santrifüj güvenlik kapları, sıçrama koruyucuları, daha güvenli kesici uçlar (örn. otomatik geri çekme iğnesi/şırınga kombinasyonları, tek kullanımlık neşterler) ve pipet yardımcıları
— İkincil muhafaza: bina tasarım özellikleri (örn. yönlü hava akışı veya negatif hava basıncı, el yıkama lavaboları, kapalı kapılar, çift kapı girişi) - İdari ve iş uygulaması kontrolleri
— Standart ve özel mikrobiyolojik uygulamalara sıkı sıkıya bağlılık (1)
— İşaretlere ve standart işletim prosedürlerine bağlılık
— Sık sık el yıkamak
— KKD'yi sadece çalışma alanında giymek
— Aerosolleri en aza indirme
— Yemeyi, içmeyi, sigara içmeyi, sakızı yasaklamak
— İğnelerin ve kesicilerin kullanımını sınırlamak ve iğnelerin yeniden kapatlanmasını yasaklamak
— Sıçramayı en aza indirme (örneğin, tezgah yüzeylerinde laboratuvar "bebekleri" kullanarak, açarken tüpleri gazlı bezle kaplayarak)
— Temizlik, dekontaminasyon ve bertaraf prosedürlerinin uygun kullanımının izlenmesi
— "Kirli" iş akışından "temiz"e uygulamak
— Tıbbi gözetim ve iş sağlığı, bağışıklama, olay raporlama, ilk yardım, maruz kalma sonrası profilaksi için tavsiyelerin ardından
— Eğitim
— Acil durum müdahale prosedürlerinin uygulanması - KKD (tehlikeye karşı bir engel sağlamada son çare olarak)
— Potansiyel olarak kirlenmiş tüm malzemeleri, kapları, ekipmanı veya yüzeyleri işlemek için eldivenler
— BSC'ler veya sıçrama koruyucuları mevcut değilse yüz koruması (yüz siperleri, maskelerle takılan sıçrama gözlükleri, yerleşik göz siperli maskeler). Ancak yüz koruması, bir BSC'nin yerini yeterince almaz. BSL-2 ve üzerinde, sıçrama veya aerosol potansiyeli olan prosedürler için bir BSC veya benzeri bir muhafaza cihazı gereklidir (Tablo 3).
— Sokak kıyafetlerinin maruz kalmasını önlemek için laboratuvar önlükleri ve önlükleri ve sağlam olmayan cildi korumak için eldivenler veya bandajlar
— Risk değerlendirmesi tarafından garanti edilirse ek solunum koruması - İş güvenliği analizi
Bir risk değerlendirmesi başlatmanın bir yolu, belirli bir protokolde yer alan adımları ve bunlarla ilişkili tehlikeleri listeleyerek ve ardından şüphelenilen organizma temelinde gerekli kontrolleri belirleyerek, her iş istasyonunda veya belirli bir laboratuvarda gerçekleştirilen prosedürler, görevler veya faaliyetler için bir iş güvenliği analizi yapmaktır (Tablo 3, Ek). BSL-2 için standart ve özel uygulamaların ötesindeki önlemler aşağıdaki durumlarda belirtilebilir:
— Şüpheli Mycobacterium tuberculosis veya diğer mikobakteriler, filamentli mantarlar, biyoterörizm ajanları ve viral hemorajik ateşler için test talepleri
— Şüpheli yüksek riskli organizma (örn. Neisseria meningitidis
— Hayvanlarla çalışın
— Büyük hacimlerle veya yüksek konsantrasyonlu kültürlerle çalışın
— Personelin zayıf bağışıklık durumu
— Yeni veya deneyimsiz personelin eğitimi
— Teknoloji uzmanı tercihi - Kontrollerin etkinliğini izleme
Risk değerlendirmesi, yeni ve ortaya çıkan patojenlerdeki, teknolojiler ve personeldeki değişiklikler nedeniyle en az bir yıllık inceleme gerektiren devam eden bir süreçtir.
— Olaylar, maruziyetler, hastalıklar ve yakın kayıplarla ilgili raporları inceleyin.
— Sebepleri ve sorunları belirleyin; değişiklik yapın, takip eğitimi verin.
— Rutin laboratuvar denetimleri yapın.
— Risk değerlendirmesini rutin olarak tekrarlayın.
2.2. Biyogüvenliğin İlkeleri (1)
2.2.1. Sınırlama
"Saklama", laboratuvar çalışanlarının, diğer kişilerin ve çevrenin maruziyetini azaltmak veya ortadan kaldırmak için laboratuvarda bulaşıcı materyalleri yönetmek için güvenli yöntemleri açıklar.
- Birincil muhafaza, personeli ve yakın laboratuvar ortamını korur ve iyi mikrobiyolojik teknik ve uygun güvenlik ekipmanlarının kullanımı ile sağlanır.
- İkincil muhafaza, laboratuvarın dışındaki çevreyi korur ve tesis tasarımı ve yapımı ile sağlanır.
2.2.2. Biyogüvenlik Seviyeleri (Tablo 4)
BSL'ler, gerçekleştirilen operasyonlar, bulaşıcı ajanın belgelenmiş veya şüpheli bulaşma yolları ve laboratuvar işlevi veya faaliyetleri için gereken uygun koruma seviyelerini sağlar. 1-4 olarak adlandırılan dört BSL, laboratuvar uygulaması ve teknikleri, güvenlik ekipmanı (birincil bariyerler) ve laboratuvar tesislerinin (ikincil bariyerler) kombinasyonlarına dayanmaktadır. Her BSL, ek sınırlama sağlamak için önceki seviyeye inşa eder. Laboratuvar müdürleri, hangi BSL'nin kendi laboratuvarlarında çalışmak için uygun olduğunu belirlemekten sorumludur.
- BSL-1, sağlıklı insan yetişkinlerde sürekli olarak hastalığa neden olduğu bilinmeyen ajanlarla çalışmak için uygundur (yani, hastalığa neden olan ajanlarla veya insanlardan veya hayvanlardan alınan örneklerle çalışmayan laboratuvarlar).
- BSL-2, yutma veya perkütan veya mukoza zarı maruziyeti (yani, insan ve hayvan klinik teşhis laboratuvarları) ile değişen şiddette insan hastalığına neden olan orta riskli ajanların ele alınması için uygundur.
- BSL-3, aerosol bulaşması için bilinen bir potansiyele sahip yerli veya egzotik ajanlarla ve ciddi ve potansiyel olarak ölümcül enfeksiyonlara neden olabilecek ajanlarla (örneğin, tüberküloz laboratuvarları) çalışmak için uygundur.
- BSL-4, bulaşıcı aerosoller tarafından yaşamı tehdit eden hastalık için yüksek bireysel risk oluşturan ve tedavisi bulunmayan egzotik ajanlarla çalışmak için ayrılmıştır (örneğin, Ebola, Marburg ve pox virüsleri ile çalışan laboratuvarlar). Bu yüksek korumalı laboratuvarlar karmaşık ve gelişmiş tesis gereksinimlerine sahiptir.
2.3. Organizmalar ve Kimyasallar için Malzeme Güvenlik Bilgi Formları
Kimyasallar için Malzeme Güvenlik Bilgi Formları (MSDS) üreticiden, tedarikçiden veya resmi bir İnternet sitesinden edinilebilir. Ulusal Sağlık Enstitüleri, İş Sağlığı ve Güvenliği Bölümü, genetik olarak manipüle edilmiş organizmaları işlemek için kılavuzlar yürürlüğe koydu ve MSDS'ye erişmek için ek talimatlara sahiptir (http://dohs.ors.od.nih.gov/material_safety_data_main.htm![]() ).
).
2.4. Biyogüvenlik El Kitabı
- Laboratuvar direktörü, laboratuvara özel bir biyogüvenlik kılavuzunun geliştirilmesini, benimsenmesini, yıllık olarak gözden geçirilmesini ve tüm laboratuvar personeli tarafından erişilebilir olmasını sağlamaktan sorumludur. Tüm laboratuvar çalışanları bu kılavuzu okumalı ve müdür, onu okuyan personelin kayıtlarını tutmalıdır.
- Kılavuz, prosedürler veya politikalar değiştiğinde yıllık olarak gözden geçirilmeli ve güncellenmelidir. Biyogüvenlik uygulamalarında yıllık eğitim laboratuvara erişen tüm personele önerilmektedir. Önerilen konular aşağıdakileri içerir.
— Kurumsal ve laboratuvar güvenliği politikaları
— Yönetim, süpervizör ve personel sorumlulukları
— Yönetmelikler ve önerilen kılavuzlar
— Laboratuvarda maruz kalma yolları
— Risk değerlendirmesi ve maruziyetlerin raporlanması
— Biyogüvenlik ilkeleri ve uygulamaları
— Bulaşıcı maddelerin güvenli kullanımı için standart önlemler
— Standart işletim prosedürleri
— Tehlike iletişimi ve biyolojik tehlike işaretleri
— Mühendislik kontrolleri
— İdari ve iş uygulaması kontrolleri
— KKD
— Bir BSC'de ne zaman ve nasıl çalışılır
— Biyolojik olarak tehlikeli maddelerin taşınması
— Acil durum prosedürleri
— Biyolojik olarak tehlikeli atıkların dekontaminasyonu ve bertarafı
— Eğitim programı ve dokümantasyon
— Tıbbi gözetim ve maruz kalma değerlendirme prosedürleri
3. Teşhis Laboratuvarlarında Temel Güvenlik Uygulamaları
Birçok güvenlik prosedürü, kılavuz ve ilke, teşhis laboratuvarının tüm bölümleri için geçerlidir. Bu bölümde sunulan öneriler, laboratuvar genelinde güvenliğin geniş bir görünümünü temsil etmektedir. Daha ayrıntılı öneriler Mikrobiyolojik ve Biyomedikal Laboratuvarlarda Biyogüvenlik'te (BMBL-5) ve Dünya Sağlık Örgütü'nün Laboratuvar Biyogüvenlik El Kitabı'nda (1,36) bulunabilir.
Hastaneler, klinik laboratuvarlar, eyalet ve yerel sağlık departmanları, CDC ve Amerikan Mikrobiyoloji Derneği, toplumda şüpheli biyoterörizm ajanları serbest bırakıldığında veya serbest bırakıldığında takip etmek için kılavuzlar oluşturdu ve/veya yayınladı. Ancak, rutin klinik laboratuvar testleri beklenmedik bir biyoterörizm olayının ilk kanıtını sağlayabilir. Rutin klinik örnekler ayrıca kültürde güçlenmesi tehlikeli olan olağandışı veya egzotik bulaşıcı ajanları barındırabilir. Bu ajanların tanımlanması genellikle zordur ve rutin tezgah teknoloji uzmanı geçiş, tekrarlanan boyama, nükleik asit testi, nötralizasyon ve diğer yöntemlerle kültür üzerinde çalışmaya devam edebilir. Bu devam eden çalışma, teknoloji uzmanını ve laboratuvardaki diğerlerini enfeksiyon riski altına sokar. İdeal olarak, bu örnekler rutin laboratuvarda işlenmemeli veya test edilmemelidir ve şüpheli ajan biliniyorsa test akışından çıkarılabilirler. Bu çabada devlet halk sağlığı laboratuvarı ve daha sonra Laboratuvar Müdahale Ağı ile ilişkiler kritik öneme sahiptir.
Test süreci başladıktan sonra, tezgah teknoloji uzmanı, laboratuvar amirinden ve/veya direktöründen ne zaman yardım isteyeceğine dair açık ve özlü talimatlara sahip olmalıdır.
3.1. Numune Alma ve Oturum Açma/Kurulum İstasyonu
- Mikrobiyoloji numuneleri, sağlam ve laboratuvar numune toplama politikasıyla tutarlı olan kirlenmemiş kaplarda alınacaktır.
- Numunelerin taşınması için pnömatik tüplerin kullanılması çoğu numune için kabul edilebilir, ancak idrar kapları gibi kapalı kapakları olmayan numuneler için kontrendike olabilir; bunlar elle teslim edilecektir (bkz. 3.1.6). Bu sistemleri kullanarak taşıma için yeri doldurulamaz numunelerin düşünülmesi durumunda özel standart işletim prosedürlerini (SOP'ler) benimseyin.
- İdeal olarak, biyogüvenlik seviyesi (BSL) 2 veya daha yüksek bir tesisteki tüm numuneler, güvenli BSC uygulamalarına bağlı kalarak bir biyolojik güvenlik kabininde (BSC) işlenecektir. Laboratuvarda bir BSC mevcut değilse, laboratuvar işleme alım örnekleri bir laboratuvar önlüğü ve eldiven giymeli, etkili bir sıçrama kalkanı kullanmalı ve evrensel önlemleri izlemeye devam etmelidir. Sahaya özgü risk değerlendirmeleri tarafından garanti edilirse ek önlemler gerekli olabilir.
- Uygun kişisel koruyucu ekipman (KKD) giyerek, plakaları aşılamak ve smear hazırlamak için 4 fit genişliğinde bir BSC kullanımını sınırlayın. Altı fit genişliğindeki BSC'ler ek test ekipmanı veya malzemelerini barındırabilir. İki çalışanın daha büyük kabinde aynı anda çalışmasına izin vermeden önce üreticinin tavsiyelerini kontrol edin ve ardından yalnızca bir risk değerlendirmesinden sonra izin verin.
- Genel kurulum alanı için minimal KKD, önlük ve eldivendir. Mikrobiyolojide cerrahi tip bir maske önerilir, ancak BSC kullanılıyorsa isteğe bağlıdır. Organizma manipülasyonunun yapıldığı mikobakteriyoloji ve viroloji laboratuvarları için, çalışanlar risk değerlendirmesinde belirtildiği gibi fit test edilmiş bir N95 solunum cihazı takmalı veya diğer uygun solunum korumasını seçmelidir. Cerrahi bir maskeden daha yüksek bir koruma derecesi sağlasa da, BSL-2'ye kadar olan biyolojik koruma seviyeleri için genellikle bir N95 solunum cihazı gerekli değildir. Güvenli BSC uygulamalarına her zaman uyulmalıdır. Mikobakteriyel, fungal, viral ve moleküler örnekler spesifik ek önlemler gerektirebilir.
3.1.1. Sızıntılı kaplar
- Numuneleri, hasta talebini numunelerden izole eden taşıma torbaları içinde laboratuvara gönderin; yanlış tanımlama ve çapraz kontaminasyonu önlemek için torbaları her zaman bir hastayla sınırlayın.
- Bir kap kırıldıysa veya içeriği döktüyse yeni bir numune isteyin. Bu kaplar kültür için kabul edilemez çünkü içerikler kirlenmiş olabilir. Olayı belgeleyin ve bir maruz kalma meydana gelirse amiri bilgilendirin.
- Varışta ve rocker'lara, santrifüjlere, raflara, kapalı tüp örnekleme (kapak delici prob) sistemlerine, otomatik alikot istasyonlarına veya otomatik kızak hazırlama sistemlerine veya konveyör bantlarına yerleştirmeden önce konteynerleri sızıntı olup olmadığını görsel olarak inceleyin.
- Çatlamış tüpler, gevşek kapaklar ve sızdıran konteynerlerle ilgili tüm olayları takip edin ve belgeleyin. Belgelenmiş olaylardaki artışlar, numune kabul politikalarını netleştirme veya güçlendirme veya numune toplama veya taşıma uygulamalarını iyileştirme ihtiyacını gösterebilir veya kusurlu konteyner parti numaralarını belirleyebilir.
- Tüm balgam kaplarını tüberküloz veya zatürree hastalarından geldiğini düşünün ve dikkatli bir şekilde ele alın. Uygun olmayan kapak kapamasından kaynaklanan dış kontaminasyon, laboratuvarın eldivenlerini ve BSC'nin tüm içeriğini kirletebilir. Numune sızdırıyorsa veya kontamine olursa, reddetmeyi ve mümkünse başka bir numune talep etmeyi düşünün. Dezenfeksiyon ve temizlikten sonra eldivenleri değiştirin ve atın. (1:10 ağartıcı solüsyonu veya uygun dezenfektan önerilir.) Raporlama amacıyla dış kontaminasyonu belgeleyin.
- Tüm kan kültürü şişelerini potansiyel olarak enfekte olmuş hastalardan (örneğin, insan immün yetmezlik virüsü [HIV] veya hepatit) geldiğini düşünün ve uygun şekilde ele alın. Dış kontaminasyonla ilgili herhangi bir endişe varsa, kan kültürü aletlerine yerleştirmeden önce tüplerin veya şişelerin dışını dikkatlice dezenfekte edin. Yakın bölgenin temizlenmesi ve dekontaminasyonundan sonra eldivenleri değiştirin ve atın. Raporlama amacıyla dış kontaminasyonu belgeleyin.
- Dışkı kaplarının sızdırılması teknoloji uzmanı için bir tehlike oluşturabilir, laboratuvarı kirletebilir veya yanlış bir sonuç üretebilecek numunenin birleşmesi ve/veya kontaminasyon için bir fırsat sunabilir. Bunlar mümkünse reddedilmeli ve yeni bir örnek talep edilmelidir. Aksi takdirde, içindekileri kültürlemeden önce kabın dışını dezenfekte edin ve devam etmeden önce eldivenleri değiştirin ve atın. Raporlama amacıyla dış kontaminasyonu belgeleyin.
- Hasarlı veya sızdıran kapları olan viral numunelerin açılmadan önce atılması gerekebilir. İşlemeye devam edip etmeme talimatları için süpervizöre başvurun ve göndereni bilgilendirmeye ve başka bir numune talep etmeye hazır olun.
3.1.2. Kapların dışında gözle görülür kontaminasyon
- Tüm numune kaplarını potansiyel olarak kontamine olarak düşünün.
- Potansiyel kontaminasyon kaynağını doğrulamak için görünür dış kontaminasyona güvenmeyin.
- Ev tipi çamaşır suyunun 1:10 seyreltilmesi gibi kabul edilebilir dekontaminantla nemlendirilmiş bir havlu veya gazlı bez kullanarak görünür kontaminasyonu silin veya yerleşik laboratuvar dezenfektanını kullanın. Analiz için numuneyi ilerletmeden önce etiket ve barkodun gizlenmediğinden emin olun.
3.1.3. Gevşek kapaklar
- Dökülmeleri ve kırılmaları önlemek için tüpleri veya numune kaplarını alırken, tıpa veya kapağı değil, her zaman numune kabının veya dışını tutun.
- Analiz veya depolama için ilerlemeden önce üstlerin tüm numune kaplarına, kan toplama tüplerine ve numune tüplerine sıkıca sabitlendiğinden emin olun.
3.1.4. Operasyonel prosedürler
- Mühendislik kontrollerinin etkin kullanımını en üst düzeye çıkarmak için numune yerleşimi, numune akışı ve tezgah operasyonel iş akışının tek yönlü (yani temiz alanlardan kirli alanlara) ve tüm operatörler için tek tip olduğundan emin olun.
- Her tezgahta gerçekleştirilen tüm operasyonların belgelenmiş risk ve tehlike değerlendirmeleri temelinde uygun KKD'yi belirleyin. Mühendislik kontrollerini ve KKD bilgilerini tüm prosedür kılavuzlarına aynı yerde dahil etmeye çalışın ve tezgahta gerçekleştirilen her işlem için bilgileri açıkça yayınlayın.
- İş istasyonu prosedür kılavuzlarının, her alandaki tüm aletlerin, malzemelerin ve malzemelerin organizasyonu için talimatların yanı sıra herhangi bir temizlik ve dezenfeksiyon için talimatlar ve tüm yüzeyler ve aletler için temizlik ve dezenfeksiyon sıklığı içerdiğinden emin olun.
- Süpervizörler, tezgahın temizliğini rutin olarak denetlemelidir.
- Atanan operasyonel görevlerle ilgili maruziyetleri azaltmak için laboratuvar dışı operasyonlar için yazılı prosedürlere sahip olun, örneğin teknik cihaz bakımı, şirket içi veya sözleşmeli bakım, acil durum müdahalesi, temizlik ve inşaat ve kamu hizmeti operasyonları.
— Laboratuvar dışı hizmet sağlayıcıları için girdileri ve istişareleri ile laboratuvar dışı operasyon prosedürlerini yazın.
— Eğitimi belgeleyin ve tüm yazılı laboratuvar dışı operasyonel tezgah prosedürleri için hizmet sağlayıcıların ve tezgah operatörlerinin yetkinliğini değerlendirin. - Genel bakteriyoloji lekeleri hem kimyasal hem de biyolojik tehlike oluşturabilir.
— Gram lekesi. Kristal menekşe, metilen mavisi, potasyum iyodür ve etanolün hepsi tahriş edicidir; kristal menekşe de kanserojendir ve biraz toksiktir; etanol bir hepatotoksindir.
— Gram leke prosedürleriyle ilişkili diğer riskler arasında canlı organizmaların kullanımı, aerosol oluşturma potansiyeli ve cilt ve çevresel kontaminasyon potansiyeli yer alır.
— Lekeleme veya leke hazırlama sırasında göz koruması (güvenlik gözlükleri veya kimyasal sıçrama gözlükleri) ve tek kullanımlık eldivenler önerilir. Eldivenler, smear hazırlanırken canlı organizmalardan koruma sağlar ve lekeye istemeden maruz kalmaya karşı koruma sağlar.
— Kirlenmiş atıkları bertaraf edilmek üzere bir biyolojik tehlike torbasına koyun. Biyolojik tehlike torbalarını yalnızca bir kez kullanın ve ardından atın. Asla yıkamayın veya yeniden kullanmayın.
— Floresan konjugatlar dahil diğer tüm lekeler için Malzemeye bakın
Her leke veya kimyasalla ilişkili Güvenlik Bilgi Sayfaları. - Ekipman dekontaminasyonu. Servis veya nakliyeden önce kan veya diğer potansiyel olarak bulaşıcı maddelerle kontamine olmuş ekipmanı inceleyin ve gerektiğinde dekontamine edin. Dekontaminasyon işlemi için üreticiye başvurun.
- Ekipmanın veya bu tür ekipmanın bölümlerinin dekontaminasyonu mümkün değilse, aşağıdakileri yapın.
— Ekipmanı bir biyolojik tehlike sembolü ve özellikle hangi kısımların kontamine kaldığını belirten ikinci bir etiketle etiketleyin.
— Uygun önlemlerin alınması için bu bilgileri taşıma, servis veya nakliyeden önce etkilenen tüm çalışanlara ve hizmet temsilcilerine iletin.
3.1.5. Sızdırmaz kapakların manuel olarak çıkarılması; numune aliquoting ve pipetleme
- Her zaman bench-fixed sıçrama kalkanının arkasındaki kapakları çıkarın veya sıçramalardan ve aerosollerden korumak için uygun ek KKD giyin.
- Kapağın üzerine bir gazlı bez yerleştirin ve ardından yavaşça kaldırın veya vücuttan uzak bir hareketle kapağı itin. Bir gazlı bezi asla tekrar kullanmayın; bunu yapmak çapraz kontaminasyona katkıda bulunabilir. Birkaç üretici, tüplerden kapakları çıkarmaya ve açık ampulleri kırmaya yardımcı olmak için güvenlik cihazları pazarlar (örneğin, Current Technologies Saf De-Cap [Fisher Health Care, Houston, TX] ve Pluggo [LPG Consulting, Inc., Wood River, IL]).
- Otomatik veya yarı otomatik pipetler ve güvenlik transfer cihazları kullanın.
3.1.6. Pnömatik boru sistemleri
- Pnömatik boru sisteminin (PTS) kullanımı ve dekontaminasyonu için SOP'ler oluşturun.
- Bir PTS kullanılarak taşınan numunelerin kırılması veya sızması, taşıma sisteminin kendisinin kontaminasyonu riski taşır.
- Tam bir risk/tehlike değerlendirmesine PTS kullanımına ilişkin sınırlamaları temel alın. Garanti ediliyorsa, tüp sistemi üzerinden gönderilen numune boyutunu, hacmini, ağırlığını ve kap tiplerini sınırlayın. Bu özellikle sitoloji örnekleri ve belirli idrar kapları için geçerlidir.
- Bir PTS aracılığıyla gönderilen tüm örnekleri kapalı bir fermuarlı torbaya yerleştirin.
- Test torbaları ve PTS'deki koşullar altında sızdırmaz olduklarından emin olun.
- Talep formlarını ayrı bir kese ile koruyun veya kontaminasyonu önlemek için ayrı bir ikincil torbaya koyun.
- Bir zip-lock torbası sadece bir hastadan numuneler içermelidir.
- Dökülmeleri emmeye ve taşıyıcının dışına kontaminasyonu en aza indirmeye yardımcı olmak için emici vatkayı hasta torbaları arasına yerleştirin.
- Kontamine pnömatik boru taşıyıcılarını standart önlemlere uygun olarak kullanın.
- Kontamine taşıyıcıları, üretici tarafından önerilen ve sistem bir hastanede kullanılıyorsa, hastanenin enfeksiyon kontrol komitesi tarafından onaylanan protokolü izleyerek ağartıcı çözeltisi veya başka bir dezenfektanla dezenfekte edin.
- Hasta numuneleri içeren PTS taşıyıcılarını açarken eldiven giyin.
- Hasta bakım alanlarına iade etmeden önce tüp taşıyıcılarının dışını dekontamine edin. Numune kabında bir sızıntı meydana gelirse taşıyıcının içini dekontamine edin.
- PTS ile ilgili sorunları derhal bildirmek için bir tesis yardım hattı kurun.
- Roller ve sorumluluklar dahil olmak üzere acil bir PTS kapatma planı oluşturun; alternatif bir örnek taşıma planının uygulanmasını dahil edin.
- Uygun olmayan şekilde kapatılmış taşıyıcılar, çatlamış tüpler, gevşek kapaklar ve sızdıran konteynerlerle ilgili olayları izlemek ve analiz etmek için bir sistem geliştirin. Belgelenmiş olaylardaki artışlar, PTS kullanım politikalarını netleştirme veya güçlendirme veya numune toplama uygulamalarını iyileştirme ihtiyacını gösterebilir ve kusurlu taşıyıcıları ve/veya konteyner parti numaralarını belirleyebilir.
- Hem laboratuvar operatörleri hem de laboratuvar dışı hizmet sağlayıcılar için girdileri ve istişareleri ile SOP'ler hazırlayın.
- PTS bakım ve dekontaminasyon prosedürleri için hizmet sağlayıcıların ve tezgah operatörlerinin belge eğitimi ve yetkinlik değerlendirmesi. Belgelenmiş eğitim ve yetkinlik değerlendirmesi, bir PTS kullanımıyla ilişkili riskler ve bu riskleri kontrol etmek için alınması gereken önlemler hakkında bilgi içerecektir.
3.2. Kişisel Önlemler.
Sıçramaları veya spreyleri önlemek için mühendislik kontrolleri mevcutsa, KKD gereksinimi, bir risk değerlendirmesi ve sıçramalardan veya spreylerden maruz kalmayı önlemek için mühendislik kontrolünün etkinliğinin kanıtı temelinde değiştirilebilir. Mühendislik kontrollerine örnek olarak, bir BSC'nin kullanımı, santrifüjlerde mühürlü güvenlik kapları veya kafaları ve laboratuvara negatif hava akışı verilebilir.
3.2.1. Açık bankta çalış
- İki iş istasyonu aynı olmadığından, her klinik laboratuvar iş istasyonu için yazılı prosedürler, potansiyel maruziyetleri azaltmak için belirli iş uygulamalarını ve iş uygulaması kontrollerini içermelidir.
- Ellerin veya eldivenlerin kan veya diğer potansiyel olarak bulaşıcı maddelerle kirlendikten sonra kullanmak üzere her çalışma alanına sıcak su içeren özel bir el yıkama lavabosu takın. Çalışanlar, teknik bir alanda çalıştıktan sonra ellerini yıkamak için yalnızca dinlenme odasındaki bir lavaboya güvenemezler. Sık sık el yıkama esastır. Sık sık el temizliğini kolaylaştırmak için her iş istasyonuna alkollü el ovma ve kazara dökülmeleri içerecek emici çalışma pedleri sağlayın. BMBL-5 (1)'de açıklandığı gibi, koruyucu gözlük, sıçrama siperi, solunum koruması ve eldivenleri kullanıma hazır hale getirin ve gerektiğinde izolat tipine göre hazır hale getirin.
- Genel mikrobiyoloji laboratuvarında, açık laboratuvarda maske ve tek kullanımlık eldiven gerekli değildir, ancak gönüllü olarak kullanılabilir. Eldiven kullanılırsa, rutin kullanım sırasında kolayca kontamine olabilirler; bu nedenle eldivenler yıkanmamalı ve yeniden kullanılmamalıdır. Eldivenleri atın ve iş istasyonundan çıkarken yeni bir çift giyin.
- İş istasyonlarındaki sıçrama koruyucuları, kan kültürü tezgahında veya sıçrama potansiyelinin bulunduğu herhangi bir istasyonda çalışırken önerilir.
- Ne kadar küçük olursa olsun, bir sıçrama veya dökülme meydana gelirse yakındaki çalışanları ve amirini bilgilendirin.
- Yapay ortamda büyüyen bakteri kültürlerinin koklanması (bazı bakteriler tarafından yayıldığı iddia edilen karakteristik kokuları tespit etmek için), birden fazla LAI türüyle ilişkilendirilmiş potansiyel olarak güvenli olmayan bir laboratuvar uygulamasıdır.
, kültür plakalarının koklanmasının yasaklanması gerektiğini tavsiye etmeye devam ediyor. Küçük gram negatif veya gram değişken çubukların (örneğin, gram negatif coccobacilli) izolatları bir BSC içinde manipüle edilmelidir.
- Laboratuvarın hiçbir yerinde açık alev brülörleri kullanmayın. Tek kullanımlık döngüler ve iğneler kullanın veya metal telli cihazlar için elektrikli yakma tesisleri kullanın.
- İş istasyonuna kolayca erişebileceğiniz bir yerde dezenfektan içeren atma kaplarını ve kesici kapları bulun.
- İş istasyonlarında bilgisayar klavyeleri için koruyucu kapaklar kullanın; kapakların en azından iş vardiyasının sonunda kolayca temizlenebilir ve tezgah üstü ile birlikte rutin olarak dezenfekte edilmesi gerekir.
- Bir iğneyle dokunurken kan kültürü şişelerini bir güvenlik sıçrama kalkanının arkasına veya bir BSC'ye yerleştirin. Kan kültürü şişelerinden alınan gram-negatif cococobacilli bir BSC içinde işlenmelidir. Brucella veya Francisella'yı (gram-negatif coccobacilli) belirleme veya ekarte etme yeteneği olmayan laboratuvarlar, bu izolatları doğrudan bir referans laboratuvarına göndermeyi düşünmeli ve bunları izole etmeye ve tanımlamaya çalışmamalıdır.
- Kültür faaliyetlerinden kalan idrar, lavabo kanalizasyonundan aşağı veya sıhhi kanalizasyona atılabilir.
- Tıbbi atıklarla kültür faaliyetlerinden kalan dışkıları ve vücut sıvıları ve solunum örnekleri gibi diğer örnekleri ve risk değerlendirmesi tarafından gerekliyse otoklavı atın.
- BSL-3 enfeksiyöz ajanların kültür faaliyetlerinden kalan dokuyu tıbbi atıklara atın ve otoklavlayın.
3.2.2. Kişisel koruyucu ekipman
Mühendislik kontrolleri (2.1.5. Adım 5) maruz kalmaları en aza indirmek için her zaman ilk savunma hattı olmalıdır.
KKD, laboratuvar çalışanını fiziksel, biyolojik ve kimyasal tehlikelere maruz kalmaktan korumak için tasarlanmış eldivenler, laboratuvar önlükleri, ayakkabı kılıfları, botlar, solunum cihazları, yüz siperleri, koruyucu gözlükler ve gözlükler gibi çeşitli öğeleri içerir. KKD'yi her çalışana gerektiği gibi dağıtmak, uygun KKD'ye erişimin sağlanmasına yardımcı olur.
KKD genellikle BSC'ler ve kullanılan ajanları veya malzemeleri içeren diğer cihazlarla birlikte kullanılır. Bir BSC'de çalışmanın pratik olmadığı bazı durumlarda, sıçrama kalkanları da dahil olmak üzere KKD, personel ve tehlikeli maddeler arasındaki birincil engeli oluşturabilir (1). (Bkz. Bölüm 3.1).
İş Güvenliği ve Sağlığı İdaresi (OSHA), normal kullanım koşulları altında kan veya diğer potansiyel olarak bulaşıcı maddelerin çalışanın sokak kıyafetlerinden, iç çamaşırlarından, derisinden, gözlerinden, ağzından veya diğer mukoza zarlarından geçmesine veya ulaşmasına izin vermiyorsa KKD'yi "uygun" olarak tanımlar (33).
- KKD standartları için kaynaklar
— Amerikan Test ve Malzeme Derneği (ASTM [şimdi ASTM International olarak bilinir]) — laboratuvar önlükleri, el koruması (tek kullanımlık eldivenler)
— Amerikan Ulusal Standartlar Enstitüsü (ANSI) Z87.1-2003 (veya daha önceki ANSI konsensüs standartları) (ABD Mesleki ve Eğitim Göz ve Yüz Koruması Standardı) — göz ve yüz koruması.
— Gıda ve İlaç İdaresi (FDA) — el koruması (eldiven).
— OSHA-KKD'nin uygun kullanımı, el koruması, çalışan eğitimi. - Laboratuvar önlükleri
— Kişisel giysilerin kirlenmesini önlemek için koruyucu laboratuvar önlükleri, önlükleri veya üniformaları tavsiye edilir. Laboratuvar dışı alanlar için ayrılmadan önce koruyucu giysileri çıkarın (örn. kafeterya, dinlenme odası, idari ofisler). Tek kullanımlık koruyucu giysileri diğer kirlenmiş atıklarla birlikte atın veya kurum tarafından aklamak için yeniden kullanılabilir giysileri depolayın.
— Aklama veya diğer kullanımlar için laboratuvar kıyafetlerini ve diğer KKD'leri eve götürmeyin. İşveren, çalışana hiçbir ücret ödemeden, potansiyel olarak kan veya diğer potansiyel olarak bulaşıcı malzemelerle potansiyel veya gözle görülür şekilde kontamine olan yeniden kullanılabilir koruyucu laboratuvar katları, önlükleri, üniformaları veya fırçalar için çamaşır yıkama hizmeti sağlamalıdır. - El koruması
— Eldivenler için ANSI standardı yoktur, ancak tek kullanımlık eldivenler için ASTM standartları, eldivenin yapıldığı belirli malzeme türüne dayanmaktadır. FDA, hasta bakımı ve vasküler erişim prosedürleri sırasında kullanılan hasta muayene eldivenlerinin zif gerekliliklerini karşıladığını ve bu kurumda 510(k) tıbbi cihaz kaydına sahip olduğunu belirtti. OSHA, seçimin gerçekleştirilen görevlere ve eldiven malzemesinin performans ve yapım özelliklerine göre yapılmasını önerir. Çalışanların ellerine en uygun bedeni seçebilmelerini sağlamak için tek kullanımlık eldivenler çeşitli boyutlarda sunulmalıdır. Eldiven malzemesinin türüne veya eldiven üretim sürecinde kullanılan hızlandırıcılara veya diğer kimyasallara karşı cilt hassasiyeti olan çalışanlar için farklı malzemelerden (örneğin nitril, kloropren) yapılmış tek kullanımlık eldivenler sağlayın.
— Laboratuvarda lateks eldiven kullanılıyorsa, çalışanın tıbbi geçmişini lateks alerjisi kanıtı için değerlendirin.
— Belirli bir operasyon için tehlike değerlendirmesini kullanarak, laboratuvar yönetimi veya atanmış bir güvenlik görevlisi veya güvenlik ekibi, görev için en uygun eldiveni seçmeli ve ne kadar süre giyilebileceğini belirlemelidir.
— Eldiven satın almadan önce, laboratuvar yönetimi veya atanmış bir güvenlik görevlisi veya güvenlik ekibi, üreticiden eldivenlerin öngörülen tehlike(ler) için uygun test standartlarını karşıladığına dair belge talep etmelidir. - Göz ve yüz koruması
— Bir sıçrama veya sprey olayı meydana geldiğinde göz ve yüz koruması (gözlük, maske, yüz siperliği veya diğer sıçrama koruyucuları) kullanılmalıdır. Bu, kapları ve pipetlemeyi açmayı, örnekleri, kültürleri, biyolojik maddeleri veya BSC dışındaki diğer tehlikeli maddeleri manipüle etmeyi, alikolamayı veya test etmeyi içerir.
— Göz ve yüz koruması kirlenirse, bu cihazlar yeniden kullanılmadan önce dekontamine edilmeli veya diğer kontamine laboratuvar atıklarıyla birlikte atılmalıdır.
— Ne gözlükler ne de kontakt lensler KKD olarak kabul edilmez. Kontakt lens takan laboratuvar çalışanları yukarıda açıklandığı gibi yüz korumasını kullanmalıdır. Düzeltilmiş görme ihtiyacı olanlar için laboratuvarda yan kalkanlı reçeteli koruyucu gözlük takın. Kimyasal bir sıçramada, kontakt lensler göz hasarını yoğunlaştırabilir çünkü lens kimyasalı daha uzun süre göze karşı tutacaktır.
— Cerrahi maskeler solunum KKD'si değildir. - Çalışan eğitimi
— İşverenler, OSHA tarafından çalışanları en azından aşağıdakileri bilmeleri için eğitmek zorundadır (37).-
KKD gerekli olduğunda
-
Hangi KKD gereklidir
-
KKD nasıl düzgün bir şekilde takılır, çıkarılır, ayarlanır ve takılır
-
KKD Sınırlamaları
-
KKD'nin uygun bakımı, bakımı, kullanım ömrü ve bertarafı
-
3.3. Biyolojik Güvenlik Kabini
- Sınıf II-A1 veya II-A2 BSC en uygun olup tanı laboratuvarı için önerilir (Tablo 5) (1). Farklı BSC sınıflarına ve türlerine genel bir bakış ve özet, BMBL-5 (1) Ek A'da mevcuttur.
- Her tanısal mikrobiyoloji laboratuvarı, bulaşıcı organizmalarla güvenli bir şekilde çalışmak için birincil bir çevreleme aracı olarak bir veya daha fazla BSC'ye ihtiyaç duyar. Amerikan Patologlar Koleji, mikrobiyoloji laboratuvarında bir BSC gerektirir. BSC eksikliği, hava yoluyla bulaşıcı olarak kabul edilen örnekleri veya organizmaları işleyen mikrobiyoloji bölümleri için Faz II eksikliğidir. Üç temel BSC türü Sınıf I, Sınıf II ve Sınıf III olarak belirlenmiştir.
— Sınıf I kabin, kimyasal bir davlumbaza benzer ve genellikle bina egzoz sistemine sert kanallıdır. Personeli ve oda ortamını korur ancak dolabın içindeki ürünü korumak için tasarlanmamıştır. Sınıf I BSC, genel laboratuvar kurulum alanında ikinci bir kabin seçimi olarak kullanılabilir.
— Uçucu kimyasalların ve toksinlerin kabin içinde manipüle edilmeyeceği çoğu teşhis laboratuvarı için, Sınıf II-A2 BSC, dışarıya sert bir kanal olmadan uygun ve en kolay şekilde kurulacaktır. Bu kabin numune işleme istasyonunda; mikobakteriyoloji, mikoloji ve viroloji laboratuvarlarında; gerekirse kimya ve hematolojide kullanılabilir. Kabin düzgün bir şekilde korunursa ve yıllık olarak sertifikalandırılırsa, hava, yüksek-verimli partikül hava (HEPA) filtreleri aracılığıyla çok az riskle odaya geri sirküle edilebilir. Mikobakteriyoloji laboratuvarındaki A-1 veya A-2 BSC de bir bina egzoz kanalına yüksük bağlantısı ve yıllık sertifikasyonu olan bir seçenektir. Bina hava akışı modelleri kabinle eşleştirilemeyeceğinden, A Sınıfı BSC'yi asla bina egzoz sistemine sabitleyemezsiniz. HEPA filtreleri, tüm bakteri, virüs ve sporları ve bu organizmaları içeren parçacıkları veya damlacıkları içeren 0,3-µm'lik parçacıkların en az %99,97'sini uzaklaştırır.
— Sınıf III kabin, Ebola virüsü ve maymun çiçeği virüsü gibi oldukça bulaşıcı ajanlar için tasarlanmıştır. - Tüm BSC'ler, ANSI/NSF Standardı No. 49'un Ek F'sine uygun olarak, en az yıllık olarak ve birim her taşındığında eğitimli profesyoneller tarafından sertifikalandırılmalıdır. Kabinin hareket ettirilmesi, yapıştırıcı ekleminde veya contada filtreye zarar vererek tehlikeli sızıntılara neden olabilir, bu nedenle filtre ve kabin bütünlüğü her hareketten sonra test edilmelidir.
- BSC'nin uygun şekilde yüklenmesi ve laboratuvarcı tarafından uygun erişim BMBL-5'te açıklanmıştır. Bazı temel kuralların vurgulanması önemlidir.
— Kollarınızı kabinin içine veya dışına süpürmeyin. Kolları yüz açıklığına dik olarak yavaşça içeri ve dışarı hareket ettirin.
— BSC'yi laboratuvara yürüyen trafikten, oda vantilatörlerinden ve oda kapılarından uzakta kurun.
— Havanın aşağı akışının yapıldığı ön ızgarayı veya kabinden havanın çıkarıldığı arka ızgarayı engellemeyin.
— Kabinin "temizlenmesine" izin vermek için üfleyicilerin çalışmaya başlamadan önce en az 4 dakika çalışmasına izin verin.
— Günün başında ve sonunda, üfleyici çalışırken, tüm yüzeyleri 1:10 seyreltme ev tipi çamaşır suyu ile dezenfekte edin ve kalan çamaşır suyunu %70 alkolle çıkarın veya karşılaşılan organizmalar için uygun başka bir dezenfektan kullanın.
— Kabinin içinde açık alev kullanmayın. İlk tercih: tek kullanımlık döngüler; ikinci tercih: elektrikli fırınlar.
— Bakımdan önce BSC'yi dekontamine etmek için, BSC kullanılmadığında formaldehit gazı, hidrojen peroksit buharı veya klor dioksit gazı kullanması için bir BSC sertifikasyon teknisyeni görevlendirin.
— Ultraviyole (UV) lambalar BSC'lerde gerekli değildir ve gerekli değildir.
— Özellikle solunum patojenleri manipüle edildiğinde, bir BSC'de yüksek hızlı ve ultrasantrifüjlerde açık sızdırmaz rotorlar veya güvenlik kapları.
— Güvenlik kapları veya sızdırmaz rotorların kullanılamadığı durumlarda, santrifüjleri bu amaç için tasarlanmış bir muhafaza cihazına veya BSC'ye yerleştirin.
— BSC içinde üretilen tıbbi atıkları torbalarda veya kesici kaplarda toplayın. Çıkarmadan önce bunları kapatın ve BSC dışındaki tıbbi atık kaplarına koyun. - Bir BSC'de çalışan bir kişi, Mycobacterium tuberculosis ile çalışan bir kişide tüberkülin cilt testi dönüşümü veya TB interferon gama salınım testi için pozitif sonuçlar gibi kabinde manipüle edilen materyali içerebilecek bir enfeksiyona sahipse, aşağıdakileri içeren bir değerlendirme yapılmalıdır:
- ilgili işin gerçekleştirildiği BSC'lerin değerlendirilmesi ve gerektiğinde onarımı ve yeniden sertifikalandırılması;
— işçinin BSC'de uygun tekniği kullandığından emin olmak için prosedürlerin değerlendirilmesi ve gerekirse işçinin uygun BSC tekniği konusunda yeniden eğitimi; ve
- laboratuvarda aynı BSC'lerde çalışan diğer kişilerin değerlendirilmesi (örn. tüberkülin deri testi) ve gerektiğinde bu kişilerin uygun BSC tekniği üzerinde yeniden eğitimi.
3.4. Dezenfeksiyon
3.4.1. İyi iş uygulamaları
- Yöntem ne olursa olsun, dekontaminasyonun amacı laboratuvar çalışanını, çevreyi ve laboratuvara giren veya laboratuvardan yapılmış laboratuvar malzemelerini işleyen herhangi bir kişiyi korumaktır. Ayrıntılı bilgi için bkz. BMBL-5 Ek A (1).
- Bir laboratuvar çalışma tezgahını dezenfekte etmek için talimatlar, her bir SOP'nin bir parçası olmalı ve hangi KKD'nin giyileceğini, yüzeylerin nasıl temizleneceğini, hangi dezenfektanın kullanılacağını ve temizlik malzemelerinin nasıl atılacağını içermelidir. Temas süresi, talimatların kritik ve gerekli bir parçasıdır. Kolay başvuru için talimatları tezgah alanına asın.
- Çalışma alanlarını kurmadan önce ve çalışma alanlarından ayrılmadan önce çevresel yüzeyleri rutin olarak temizleyin.
- Kullanılmış eldivenlerle dokunulan herhangi bir öğeyi (örn. zamanlayıcı, kalem, telefon, termometre) temizleyin.
- Yüzey alanlarını dezenfekte etmek için tek başına alkol veya alkol bazlı çözeltiler kullanmayın. Bunlar kolayca buharlaşır ve bu da etkinliği önemli ölçüde azaltır. Hepatit B virüsü, HIV ve diğer kanla bulaşan patojenlere karşı etkili Çevre Koruma Ajansı (EPA) kayıtlı dezenfektanlar gibi çevresel yüzeyler için önerilen dezenfektanları kullanın veya 1:10 seyreltme ev tipi çamaşır suyu kullanın. EPA çevre dezenfektan ürün kayıt bilgileri http://www.epa.gov/oppad001/chemregindex.htm adresinde mevcuttur.
 .
. - Yeniden kullanılabilir tıbbi cihazların işlenmesi için FDA tarafından temizlenen yedek sterililanlar ve üst düzey dezenfektanlar. FDA, bu ürünler için üreticileri, aktif maddeleri ve temas koşullarını belirlemiştir. FDA onaylı sterilanlar ve üst düzey dezenfektan listeleri http://www.fda.gov/cdrh/ode/germlab.html adresinde mevcuttur.
 .
. - Bir dökülme meydana geldiğinde tezgah yüzeylerini, sabit rafları, kil fayansları, rocker'ları, sürgülü boyama raflarını, su/ısıtma banyolarını ve tüm tepsileri temizleyin. Her vardiyanın sonunda tüm yüzeyleri temizleyin.
- Tek kullanımlık astarların kullanımı, ekipmanın temizleme aralıklarını azaltabilir, ancak yüzey alanlarını veya ekipmanı temizleme ihtiyacının yerini almaz. Astar atıldığında alttaki tezgah yüzeyini temizleyin. Astar, her vardiyanın sonunda veya kontamine edilmişse dezenfekte edilmeli veya atılmalıdır.
- Tek kullanımlık, esnek, polietilen film destekli, kaymayan yüksek emici yüzey astarları ticari olarak mevcuttur ve boyalar ve aşındırıcı kimyasallar da dahil olmak üzere çoğu çözeltinin ıslanmasını önlemeye yardımcı olur. Kontaminasyondan sonra ve vardiyanın sonunda daima tıbbi atıklarla birlikte atın.
- Nüfuz etme ve kolay çıkarmayı sağlamak için kurutulmuş kan veya vücut sıvısının laboratuvar- tarafından belirtilen dekontaminasyon çözeltisiyle en az 20 dakika temasa izin verin (1). Yüzey bölgelerinden kurutulmuş kanı veya vücut sıvısını kazımak için asla bıçak veya başka bir alet kullanmayın; bunu yapmak perkütan yaralanmaya neden olabilir veya aerosol üretebilir.
3.4.2. Ağartma çözeltileri (sodyum hipoklorit) (38)
- Hipoklorit çözeltileri tahriş edici ve aşındırıcı olarak sınıflandırılır. Seyreltilmemiş ağartıcı çözeltisi paslanmaz çeliğe karşı aşındırıcıdır ve kalıntıyı gidermek için BSC ve paslanmaz çelik lavabolarda kullanımını kapsamlı bir şekilde durulama takip etmelidir. Ağartıcı çözeltilerini otoklavlamayın.
- Asla farklı klor çözeltilerini karıştırmayın veya bunları amonyak, amonyum klorür veya fosforik asit içeren temizlik ürünleriyle saklamayın. Bu kimyasalları birleştirmek, mide bulantısı, göz tahrişi, yırtılma, baş ağrısı ve nefes darlığına neden olabilecek klor gazının salınmasına neden olabilir. Bu belirtiler birkaç saat sürebilir. Bir klor çözeltisini bir temizlik ürünü ile karıştırdıktan sonra hoş olmayan derecede güçlü bir kokuya maruz kalan bir işçi, odayı veya alanı hemen terk etmeli ve dumanlar tamamen temizlenene kadar alanın dışında kalmalıdır (bkz. Bölüm 9.1).
- Etkili bir dezenfektan olması için, çalışan ağartıcı çözeltileri >%0,5 ancak <%2 sodyum hipoklorit içermelidir. Ev tipi çamaşır suyundaki hipoklorit konsantrasyonu üreticiye göre değişir. Birçok ev tipi ağartıcı çözeltisi %5,25 sodyum hipoklorit içerir ve 1:10 seyreltme (5.000 ppm Cl) %0,53 hipoklorit çözeltisi üretecektir. Daha düşük hipoklorit konsantrasyonlarına sahip ağartıcı çözeltilerinin kullanılması uygun düzeyde dezenfeksiyon sağlamayabilir. Her gün taze bir 1:10 ev tipi çamaşır suyu çözeltisi hazırlayın.
3.5. Atık Yönetimi
Bir klinik laboratuvar bir atık yönetim planı oluşturmalıdır.
- Yerinde atık yönetim planının bir parçası olarak, laboratuvar yönetiminin veya belirlenen güvenlik görevlisinin veya güvenlik ekibinin sorumlulukları
- bir atık azaltma veya minimizasyon programı oluşturmak;
— laboratuvar tarafından üretilen tüm atık kategorilerini tanımlamak ve tanımlamak;
- üretilen her atık kategorisi için, bu atık kategorisinin laboratuvar içinde, laboratuvar dışında ve tesis dışında nasıl ayrılacağı, paketleneceği, etiketleneceği/renk kodlu, depolanacağı, taşınacağı ve takip edileceği de dahil olmak üzere federal, eyalet ve yerel düzenlemelerin uygulanabilirliğini belirleyin;
- halkın veya müşterilerin erişimini önlemek için tüm düzenlenmiş atıkları ayırmak;
— tıbbi atık yönetimi ile ilgili tüm sorunları veya sorunları raporlamak ve bunlara yanıt vermek için bir sistem kurmak; ve
— arıtma ve bertaraf proseslerinin kurulması (39). Düzenlenmiş atıkların bertarafı, eyalet ve yerel lisans gerekliliklerini karşılayan bir şirket tarafından yapılmalıdır.
3.5.1. Tıbbi atıkların taşıma ve bertaraf edilmeden önce dekontaminasyonu
- "Enfeksiyöz tıbbi atık", hastalığı bulaştırabilen atık olarak tanımlanır. "Düzenlenmiş tıbbi atık", sıvı veya yarı sıvı formda önemli miktarda kan veya kan ürünleri ile veya kontamine keskinlerle kontamine edilmiş herhangi bir atıktır. Daha yüksek bir risk seviyesi sağladığı ve böylece eyalet veya yerel makamlar tarafından düzenleyici hükümleri garanti ettiği kabul edilir.
- Klinik laboratuvarlar, kuruluşlarının düzenlenmiş tıbbi atıklarını yöneten federal, eyalet ve yerel yasaları belirlemeli ve kuruluşun bu yasalara uygun olmasını sağlamalıdır. Eyalet ve/veya yerel düzenlemeler gerektirebilir
— tıbbi atık üretmek için izinler veya kayıt numaraları;
— bir atık yönetim planının geliştirilmesi ve uygulanması; ve/veya
— özel kayıt tutma uyumluluğu. - Çevre hizmetlerinin eyalet departmanları (veya eşdeğeri), eyalet ve yerel tıbbi atık yasalarına uyma konusunda yardım için mükemmel bir kaynaktır. Tıbbi atıkları düzenleyen eyalet yasalarını bulmak için http://www.epa.gov/epawaste/nonhaz/industrial/medical/programs.htm adresini ziyaret edin.
 . Eyaleti seçin, ardından "Birincil Malzemeler-Durumlar, Kodlar ve Düzenlemeler"in altına bakın. Atık yönetimi hakkında bilgi için eyaletin "İdari Kodları"nı" veya "Tüzükleri"ni arayın. (Bazı eyaletler "düzenlenmiş tıbbi atık" veya "özel atık" gibi "enfeksiyöz tıbbi atıklar" için başka terimler kullanır.)
. Eyaleti seçin, ardından "Birincil Malzemeler-Durumlar, Kodlar ve Düzenlemeler"in altına bakın. Atık yönetimi hakkında bilgi için eyaletin "İdari Kodları"nı" veya "Tüzükleri"ni arayın. (Bazı eyaletler "düzenlenmiş tıbbi atık" veya "özel atık" gibi "enfeksiyöz tıbbi atıklar" için başka terimler kullanır.) - OŞA. 29 CFR Bölüm 1910.1030, Kanla Bulaşan Patojenlere Mesleki Maruz Kalma, taşınırken veya bir laboratuvar dışında taşınırken kan ve vücut sıvılarının etiketlenmesi ve paketlenmesi için minimum gereksinim sağlar. Bilgi yerel OSHA ofisinden veya çevrimiçi olarak edinilebilir (33).
- Laboratuvar yönetimi, çalışanların bu yasaları anlamasını ve düzenlenmiş tıbbi atıkların bir tesisteki tıbbi olmayan atıklarla karıştırılmamasını sağlamalıdır.
- Çalışan eğitiminin ve yetkinlik değerlendirmesinin tamamlanmasını belgeleyin
- kullanımdan önce montaj gerektiren tıbbi atıklar için kapların inşa edilmesi ve uygun şekilde etiketlenmesi;
- tıbbi atıkların uygun şekilde etiketlenmiş kaplara atılması;
— uygun malzemelerin kullanımı, örn. kaplar, uygun plastik poşetler, etiketleme; ve
- atık yönetimi ile ilgili tüm federal, eyalet ve yerel düzenlemeleri takip ederek, yani tıbbi atıkların ele alınması, tıbbi atıkların derhal bertaraf edilmesi, tıbbi atıkların depolanması, taşıma konteynerlerinin gerekli herhangi bir Ulaştırma Bakanlığı etiketlemesini (örneğin, "Biohazard" kelimesi ve evrensel biyolojik tehlike sembolü) içeren tıbbi atıkların taşınması ve tıbbi atıkların nihai imhası.
3.5.2. Atılan kültürlerin ve stokların yönetimi
- Enfeksiyöz ajanların kültürleri ve stoklarını atarken laboratuvarın biyogüvenlik seviyesi dikkate alınmalıdır.
- BLS-3 fiziksel muhafazası altında ele alınan atılan kültürler ve organizma stokları (örneğin, M. tuberculosis), kapalı, sızdırmaz ve evrensel biyolojik tehlike sembolü ve "Biohazard" kelimesi ile postalanmış kaplarda toplanacak ve mühürlenecektir. Kapların daha sonra yerinde otoklavlanması gerekir. Diğer yerinde tıbbi atık arıtma teknolojilerinin kullanılması, bu teknolojilerin organizmaları sterilize edilmesi, uygun şekilde doğrulanması ve uygun devlet çevre düzenleme kurumu tarafından tıbbi atık arıtma teknolojileri olarak tanınması durumunda düşünülebilir.
- BSL-2'de ele alınan atılan kültürleri ve organizma stoklarını dekontamine edin. Bu işlem yerinde ancak mikrobiyoloji bölümünden uzakta yapılırsa, atılan kültürleri ve stokları taşındıklarında güvence altına alınan dayanıklı, sızdırmaz kaplara yerleştirin. Dekontaminasyon, bir tıbbi atık arıtma yüklenicisinin tesisi tarafından, atık tıbbi atık nakliye konteynerlerine yerleştirilir ve geçerli düzenleyici standartlara uygun olarak paketlenirse yapılabilir. Bu faaliyetlerin olası maruziyetleri en aza indirecek şekilde yapılıp yapılamayacağını belirlemek için bir risk değerlendirmesi yapın. Değerlendirme, bu atıkların saha dışında güvenli bir şekilde yönetilip yönetilemeyeceğini veya sahada yönetilmesi gerekip gerekmediğini belirleyecektir.
3.5.3. Seçilmiş bir aracıyı atmak
- Tanı veya doğrulama için sunulan bir örnekte bulunan belirli ajanları veya toksinleri tanımlayan klinik veya teşhis laboratuvarları ve diğer kuruluşlar, yönetmelik (7 CFR 331, 9 CFR 121 ve 42 CFR 73) tarafından, kimliği 7 takvim günü içinde ABD Hayvan ve Bitki Sağlığı Denetim Servisi'ne (APHIS) bildirmek zorundadır. Tarım Bakanlığı veya CDC'ye. Ayrıca, bu laboratuvarların veya kuruluşların, numunenin alınmasından sonraki 90 gün içinde yeterlilik testi için alınan numunelerden belirli ajanların ve toksinlerin tanımlanmasını bildirmeleri gerekmektedir.
- Yerel tesiste veya bir referans laboratuvarı tarafından tanımlanmış olsun, Brucella spp., Coccidioides immitis veya Yersinia pestis gibi tanımlanmış seçilmiş ajanları içeren kültürlerin bertarafı, Select Agent Kuralı (40) kapsamındadır. APHIS/CDC Form 4, "Seçilmiş bir Ajan veya Toksinin Tanımlanması Raporu", klinik veya teşhis laboratuvarları ve diğer kuruluşlar tarafından, teşhis, doğrulama veya yeterlilik testi sonucu olarak seçilmiş bir ajan veya toksinin tanımlanmasını ve bu ajanın veya toksinin nihai eden çıkarılmasını APHIS veya CDC'ye bildirmek için kullanılır. İzolat, tanımlandıktan sonra 7 gün içinde imha edilirse veya kayıtlı bir laboratuvara gönderilirse ve CDC'ye izolatın imhası bildirilirse başka bir bildirime gerek yoktur.
- Seçilmiş bir ajan veya toksin, yerinde otoklavlama ile yok edilebilir. Tesis için bir tıbbi atık yüklenicisi kullanılıyorsa, tanımlanan ajanı veya toksini içeren kültürler, önce açık kültür kaplarını tıbbi atıklara atmadan önce gece boyunca taze 1:10'luk bir çamaşır suyu çözeltisine batırılarak tamamen etkisiz hale getirilmelidir. Tıbbi atık yüklenicisi Select Agent Programına kayıtlıysa, canlı kültürler resmi olarak APHIS/CDC Form 2, "Seçilmiş Ajanları ve Toksinleri Transfer Etme Talebi" kullanılarak yükleniciye aktarılabilir. Seçilmiş ajan kuralı ve klinik laboratuvarlar üzerindeki etkisi ile ilgili ayrıntılar Klinik Mikrobiyoloji Bülteni, 15 Nisan 2006'da (41) bulunabilir.
3.5.4. Otoklav güvenliği
- Yerçekimi yer değiştirme buhar sterilizatörleri (otoklavlar) mikrobiyoloji (viroloji dahil) laboratuvarlarında sıklıkla kullanılmaktadır. Otoklavlar önemli miktarda ısı ve basınç üretir ve tüm kullanıcılar ilgili riskleri anlamalı ve saygı göstermelidir.
- Otoklavı işleten personel, ünitenin sterilizasyon döngüsünü doğrulamak için kullanılan prosedürlere uygun olarak otoklavlanacak materyalleri paketlemek, yüklemek ve etiketlemek için eğitilmelidir. Ayrıca acil durum prosedürleri konusunda da eğitim almaları gerekiyor.
- Eski otoklavların yanlarına veya arkalarına dokunmayın; çok az ısı koruyucuları vardır veya hiç yoktur ve yanıklara neden olabilirler.
- Yanıcı maddeleri (ör. karton, plastik malzemeler) veya yanıcı sıvıları otoklavın yanına istiflemeyin veya saklamayın.
- Toksik maddeler, aşındırıcılar (örn. asitler, bazlar, fenol), çözücüler veya uçucu maddeler (örn. etanol, metanol, aseton, kloroform) veya radyoaktif maddeler içeren otoklav malzemeleri asla yapmayın.
- Otoklavlanacak tüm biyomedikal atıkları otoklavlamadan önce onaylanmış, biyotehlikeli etiketli bir otoklav torbasına koyun. Tüm kırmızı veya turuncu çantalar otoklavlanamaz. Otoklavlama atıklarında kullanılmak üzere seçilen torbalar bu amaç için özel olarak üretilmelidir. Tıbbi atıkları otoklavlarken sadece otoklavlarda kullanım için uygun olarak belirlenmiş poşetleri kullanın.
- Tüm kesicileri (örn. iğneler, neşterler, pipetler veya kırık cam) sterilize etmeden önce onaylanmış, sızdırmaz, etiketli ve sert bir kesici kap kabına koyun.
- Tezgah kağıdı veya kağıt önlük gibi bir torba kuru malları dekontaminasyon yaparken, torba içinde buhar üretimini kolaylaştırmak için otoklav torbasına 100 mL su koyun.
- Torbaları veya otoklav ünitesini fazla doldurmayın; bu, sterilizasyon işlemine müdahale edebilecek yetersiz buhar sirkülasyonuna neden olabilir.
- Otoklav torbalarını bükümlü bağlarla veya içeride buhara izin veren diğer yollarla gevşek bir şekilde kapatın.
- Otoklavlama için torbaları paslanmaz çelik veya polipropilen tepsilere yerleştirin. Torbaları doğrudan otoklavın içine koymayın.
- Açmadan önce her zaman bir otoklav ünitesinin soğumasına izin verin. Geriye yaslanın ve fazla buharın kaçmasına izin vermek için kapıyı yavaşça açın. İşlemden önce içeriğin soğumasına izin verin. Otoklavdan sıcak eşyaları çıkarmak için her zaman kalın, dirsek-uzunlukta, ısıya-dayanıklı, sıvı-geçirimsiz eldivenler kullanın.
- Otoklavlamadan sonra, çubukların siyah olduğundan emin olmak için otoklav gösterge bandını kontrol edin. Gösterge bandı etkin değilse, yükü yeniden sterilleştirin.
- Otoklavın düzgün performans gösterdiğinden emin olmak için en az haftalık olarak Bacillus stearothermophilus spor şeritleri (veya eşdeğeri) gibi bir biyolojik gösterge kullanın. Bu ekipman için contaları, drenajları ve diğer kritik yönleri değerlendiren düzenli bir bakım programı oluşturun ve izleyin.
3.6. Kuru Buz
3.6.1. Genel bilgi
Belirli koşullar altında kuru buz patlama tehlikesi oluşturabilir. Kuru buz katılaşmış karbondioksittir (CO) ve aşırı soğuktur (-109° F [-79° C]). Water-ice'ın aksine, kuru buz, ısındıkça süblime eder (doğrudan katıdan gaza değişir) ve CO gazı serbest bırakır. CO buharı havadan önemli ölçüde daha ağırdır; kapalı, yetersiz havalandırılan alanlarda havanın yerini alarak boğulmaya neden olabilir.
- Cilt ve gözlerle kuru buz temasından kaçının. Kuru buz, doğrudan temastan sonraki saniyeler içinde şiddetli donmalara neden olabilir.
- Kuru buzu asla cam veya kapalı kaplara koymayın. Kapalı bir kapta depolama, kabın aşırı basınçtan yırtılmasına veya patlamasına neden olabilir.
- Kuru buzu asla çıplak elle tutmayın. Daima yalıtımlı eldivenler ve koruyucu gözlük takın. Laboratuvar önlüklerinin kullanılması da tavsiye edilir. Kuru buz bloklarını işlemek için maşa kullanın. Peletlenmiş kuru buzu taşımak için kepçe kullanın.
- Ağza kuru buz koymayın veya başka bir şekilde yutmayın. Yutulursa, kuru buz ciddi iç yaralanmalara neden olabilir. Onları soğutmak için içeceklere asla kuru buz koymayın.
- Kuru buz taşırken, kabı arabanın veya kamyon yatağının bagajına yerleştirin ve temiz hava sirkülasyonu için araba camlarını açık bırakın. Park edilmiş bir yolcu aracında asla kuru buz bırakmayın. Kapalı bir yolcu aracında kuru buzun süblimleştirilmesi, tehlikeli boğucu CO buharı konsantrasyonlarının birikmesine neden olabilir. Kuru buz içeren kapalı bir kargo alanını açarken, girmeden önce kapalı alanın 5 dakika havalandırılmasına izin verin.
- Kuru buzu doğrudan tezgah üstlerine, fayanslara, lamine tezgahlara veya seramik lavabolara koymayın. Çift kalınlıklı karton veya ahşap gibi bir yalıtım bariyeri kullanın. Kuru buz, fayansı veya lamine malzemeyi yerinde tutan yapıştırma maddesini tahrip edebilir. Kuru buz ayrıca tezgah üstlerinin ve seramik lavaboların çatlamasına neden olabilir.
3.6.2. Kuru buzun bertarafı
- CO buharının birikemeyeceği iyi havalandırılmış bir alanda kuru buzun süblime olmasına veya atmosfere buharlaşmasına izin verin.
- Kuru buzu kanalizasyonlara, lavabolara veya tuvaletlere atmayın. Aşırı soğuk, seramik armatürleri kırabilir veya polivinil klorür (PVC) borularını kırabilir. Sıhhi tesisat yıkanırsa, gaz birikimi patlamaya neden olabilir.
- Kuru buzu çöp kutularına veya benzeri kaplara koymayın. Aşırı soğuk ve bunun sonucunda ortaya çıkan yoğuşma bu kapları yok edebilir.
3.7. Elektrik Güvenliği
- Elektrik tehlikeleri iki ana türe kategorize edilebilir: elektrik çarpmasına neden olabilecekler ve yangınlara ve/veya patlamalara neden olabilecekler.
- Ekipman ve elektrik kablolarının ve fişlerinin iyi durumda olmasını, topraklanmış prizlerin kullanılmasını ve lavaboların, göz yıkamalarının, acil duşların veya diğer su kaynaklarının yakınında toprak arızası kesme çıkışlarının veya devre kesicilerin kullanılmasını sağlayarak elektrik şokları önlenebilir.
- Elektrik devrelerini aşırı yüklemeyin. Çok çıkışlı güç şeritlerinin kullanımını en aza indirin veya ortadan kaldırın. Elektrik prizleri gerektiğinde, tesisin güvenlik ofisi veya lisanslı bir elektrikçi bunların kullanımını onaylamalıdır.
- Bakım yapılmadan önce devre aktivasyonunu önlemek için yüksek voltajlı veya yüksek amperli güç kaynaklarına bağlı ekipmanın bağlantısını kesin veya kesici kutusu üzerinde bir kilitleme cihazı sağlayın.
- Elektrikli cihazlar kıvılcım üretebileceğinden, bunları yanıcı veya uçucu gazların veya sıvıların yakınında kullanmayın.
- Yanıcı sıvıları asla ev tipi bir buzdolabına koymayın. Kapı ile etkinleştirilen ışık anahtarı tarafından üretilen kıvılcım, ünitede sıkışan dumanları ateşleyerek patlamaya ve yangına neden olabilir.
- Patlama potansiyeli olan kimyasalları depolarken özel buzdolapları kullanılmalıdır.
3.8. Laboratuvardaki Gazlar: Sıkıştırılmış Gaz Silindirleri
Sıkıştırılmış CO silindirleri genellikle CO inkübatörlerine gaz sağlamak için kullanılır; oda iyi havalandırıldığı sürece bu inkübatörlerle ilişkili riskler minimumdur.
3.8.1. Tehlikeler
- Gaz silindirleri üç büyük güvenlik tehlikesi oluşturur:
— Gaz tüpleri ağırdır; bu nedenle, düşen bir silindir yaralanmaya neden olabilir.
— Silindire bağlı valf, silindire kıyasla nispeten kırılgandır; valf kırılırsa, silindir tehlikeli bir mermi haline gelebilir.
— Arızalı valfler veya regülatörler sızdırarak zehirli veya yanıcı gazların odaya girmesine izin verebilir. - Elektron mikroskobu laboratuvarında, vakum odalarını atmosferik basınca getirmek için azot kullanılır ve kritik nokta kurutucular, elektron mikroskobu örneklerini taramak için kurutma işleminde geçiş sıvısı olarak CO kullanır.
- Argon, püskürtme kaplayıcılarında kullanılır ve bazı laboratuvarlar, oksijen gerektiren biyolojik örneklerin plazma kılını gerçekleştirir (42).
3.8.2. Tehlikeleri en aza indirme
Bu potansiyel tehlikelerin çoğu, güvenli elleçleme uygulamalarının benimsenmesiyle en aza indirilebilir.
- Düşmeyi önlemek için silindirler, zincirler veya kayışlarla duvara güvenli bir şekilde sabitlenmelidir. 18 inçten küçük silindirler, onaylı standlara veya duvar braketlerine sabitlenebilir.
- Yeni bir silindir takarken, silindir sabitlenene kadar koruyucu valf kapağını yerinde bırakın. Kayışlar veya zincirler silindirden çıkarılmadan önce koruyucu valf kapağını değiştirin.
- Her gaz tipi için özel regülatörler ve diş açma tasarlanmıştır. Dişleri zorlamaya çalışmayın veya bir tankta yanlış regülatör kullanmayın.
- Regülatörlere normalde güvenli çalışmayı sağlamak için rutin bakım ve periyodik kontrol talimatları verilir. Bu talimatları ve kontrolleri dikkatlice takip edin.
- Silindirleri hareket ettirirken daima özel olarak tasarlanmış silindir arabaları kullanın. Silindirler arabaya sabitlenmeli ve hareket ettirirken valf kapakları takılmalıdır. Sürüklenmemeli, yuvarlanmamalı veya fiziksel olarak taşınmamalıdırlar. Silindirleri kapaktan yukarı kaldırmayın.
3.9. Sıvı Gazlar (Kriyojenler)
Kriyojenik sıvılar, normal kaynama noktası -238°F (-150°C) altında olan sıvılaşmış gazlardır. Mikrobiyoloji laboratuvarında hücreleri ve virüs stoklarını dondurmak ve korumak için sıvı azot kullanılmaktadır. Elektron mikroskobu laboratuvarı, donmuş bölüm süitleri ve cerrahi patoloji için brüsül istasyonları sıklıkla sıvı azot kullanır; bazı laboratuvarlar da sıvı helyum kullanır. Kriyojenik sıvıların taşınmasıyla ilgili temel tehlikeler arasında soğuk temas yanıkları ve donma, boğulma, patlama ve malzeme gevrekliği bulunur.
3.9.1. Soğuk temas yanıkları ve donma
- Sıvı azot tehlikeli derecede soğuktur (-320°F [-196°C]) ve sıvı veya gaz fazı ile cilt teması hemen donmaya neden olabilir. -450°F'de (-68°C), sıvı helyum tehlikelidir ve atmosferik havayı katılaştıracak kadar soğuktur.
- Her zaman göz koruması takın (güvenlik gözlükleri üzerine yüz siperliği). Gözler donmaya karşı son derece hassastır ve sıvı azot veya sıvı azot buharları göz hasarına neden olabilir.
- Korunmasız herhangi bir cildin yalıtımsız borulara, hortumlara, maşalara, sparger'lara, numune kutusu saklama raflarına veya diğer metal nesnelere temas etmesine izin vermeyin, çünkü bunlar sıvı nitrojene maruz kaldıklarında aşırı derecede soğur. Deri metale yapışacak ve ondan çekilmeye çalışıldığında eti yırtacaktır.
- Kriyojenik dewarları doldururken, uzun kollu gömlekler veya laboratuvar önlükleri, uzun pantolonlar (tercihen sıvıyı hapsedebilecek manşetsiz), kapalı ayakkabılar (asla sandalet veya açık ayakkabılar) ve kriyojenik sıvılarla kullanım için uygun olarak etiketlenmiş yalıtımlı kriyoglovlar giyin. Pantolon bacaklarını ayakkabıya veya botlara sokmayın; bunu yapmak sıvıyı ayak kaplamalarına yönlendirebilir ve kriyojenik sıvıyı cilde hapsedebilir.
- Dewars'ı doldururken dirsek uzunluğunda manşetli bol oturan termal eldivenler giyin. Eldivenlerin sıvıya temas ettiklerinde hızlı bir şekilde atılacak kadar gevşek olduğundan emin olun.
- Eldivenli elleri asla sıvı nitrojene veya sıvı azot akışına koymayın. Eldivenler bu tür maruz kalma için derecelendirilmemiştir. Yalıtımlı eldivenler, hortumların veya dağıtıcıların taşınması sırasında ve sıvı ile tesadüfi temas sırasında kısa süreli koruma sağlamak üzere tasarlanmıştır. Sıvı azottan ürün alırken özel kriyojenik sıvı maşa kullanın.
- Sıvı azot, yüksek bir sıçrama riski taşır; çok daha yüksek sıcaklıklarda olan kabonlar, teneke kutular ve diğer nesneler sıvı nitrojene yerleştirildiğinde sıvı azot jetleri üretilebilir. Bu faaliyetler donma tehlikesi oluşturabilir.
- Sıvı nitrojenin içine içi boş bir tüp sokmayın çünkü tüpten sıvılanmış gaz fışkırabilir.
3.9.2. Boşalma tehlikeleri
- Azot toksik olmamasına ve inert olmasına rağmen, havadaki oksijeni yaşamı desteklemek için gereken seviyelerin altına çıkararak bir asfiksant görevi görebilir. Azotun aşırı miktarda solunması baş dönmesi, bulantı, kusma, bilinç kaybı ve uyarı yapılmadan ölüme neden olabilir.
- Sıvı kriyojenler oda sıcaklığında atmosfere atıldığında buharlaşır ve sıvı hacimlerinin 700-800 katına kadar genişlerler. Küçük miktarlarda sıvı bile büyük miktarlarda oksijen gazının yerini alabilir ve atmosferin oksijen içeriğini güvenli bir seviyenin altına düşürebilir (23,38,42,43).
- Dewar'ları veya azot kaplarını kapalı bir alanda saklamayın. Havalandırma gazı, bir tehlike haline gelmek için yeterli oksijenin yerini alabilir.
- Kapalı alanların kullanılması gerekiyorsa, oksijen monitörleri takın. Alarm çalarsa personeli hemen bölgeyi terk etmeleri için eğitin. Alarm, kimsenin odaya girmesini önlemek için hem odanın içinde hem de dışında sesli olmalıdır.
3.9.3. Patlama tehlikeleri
- Sıvı gazlar, inert olarak kabul edilenler bile patlama tehlikeleri oluşturabilir.
- Kriyojene ısı akısı, yalıtım kalitesinden bağımsız olarak kaçınılmazdır. Kriyojenik sıvılar küçük gizli ısılara sahiptir ve oda sıcaklığına ısındıkça 700-800 kat genişleyecektir. Bu nedenle, küçük bir ısı girişi bile kap içinde büyük basınç artışları oluşturabilir.
- Dewars dikkatli bir şekilde hareket ettirilmelidir. Sıvıyı kabın daha sıcak bölgelerine sokmak keskin basınç artışlarına neden olabilir.
- Kapları yanlarına düşürmeyin, uçmayın veya yuvarlamayın; bunu yapmak gemiye zarar verebilir ve/veya iç basınçta keskin bir artışa neden olabilir.
- Kriyojenik kaplar, iç basıncı kontrol etmek için tasarlanmış basınç tahliye cihazları ile donatılmıştır. Kriyojenik kaplar gazları periyodik olarak havalandıracaktır. Bu normaldir. Herhangi bir basınç tahliye cihazını takmayın, çıkarmayın veya kurcalamayın.
- Havalandırmalar buzlanma ve tıkanmaya karşı korunmalıdır. Tüm havalandırma delikleri kapatıldığında, genişleyen gaz bir patlamaya neden olabilir. Havalandırmalar her zaman açık tutulmalıdır.
- Sıvı azot tutmak için her zaman özel ultra düşük-sıcaklık kapları kullanın. Sıvı nitrojeni asla ev tipi termos şişelerine koymayın, çünkü bunlar sıvı azot kaba yerleştirildiğinde meydana gelen büyük ve hızlı sıcaklık değişimlerine dayanacak şekilde tasarlanmamıştır (42,43).
- Soğutmanın iç gerilmelerini en aza indirmek için sıvı azot dewars'ı yavaşça doldurun. Aşırı stres gemiye zarar verebilir ve başarısız olmasına neden olabilir.
- Sıvı helyum, atmosferik havayı katılaştıracak kadar soğuktur. Sadece helyum tanıtılacak veya bir sıvı helyum dewar'ın helyum hacmine girmesine izin verilecektir. Havanın helyum hacmine geri yayılmasını önlemek için önlemler alın.
- Sıvı azot ve sıvı helyum, sıvı oksijenin altında kaynama noktalarına sahiptir ve atmosferden oksijeni yoğunlaştırabilirler. Sistemin tekrar tekrar yenilenmesi, oksijenin istenmeyen bir kirletici olarak birikmesine neden olabilir. Benzer oksijen zenginleştirmesi, kriyojenik boruların dışında yoğun havanın biriktiği yerlerde meydana gelebilir. Bu oksijen bakımından zengin sıvının yalıtımı veya oksijenle uyumlu olmayan diğer malzemeleri ıslatmasına izin verilirse bir patlama meydana gelebilir. Ayrıca bazı yağlar sıvı oksijen ile birleştirildiğinde patlayıcı bir karışım oluşturabilir.
3.9.4. Kriyotube patlamaları
- KKD, bir ANSI spesifikasyonu, darbeye dayanıklı yüz siperi, ağır eldivenler ve azot tanklarından kriyotüplerin ve ampullerin çıkarılması sırasında düğmeli bir laboratuvar önlüğü içerir.
- Hücreleri ve virüsleri dondurmak için kullanılan kriyotüpler ve cam ampuller, kriyojenik depolamadan çıkarıldığında uyarı yapılmadan patlayabilir. Bu tüp patlamalarının, sıvı nitrojenin küçük çatlaklardan tüpe girmesinden kaynaklandığı varsayılmaktadır; tüp çözüldükçe, hızla genişleyen gaz, tüpün patlamasına ve tüpün içeriğini saçmasına neden olur (23).
- Mümkün olduğunda, ampulleri kriyojenik dewar'ın sıvı nitrojenine batırmak yerine gaz fazında saklayın. Kusurlu bir şekilde kapatılmış bir ampul, gaz halindeki fazda daha az azot alır.
- Kusurlu şekilde kapatılmış bir flakondan azot gazı çıkması, bazen şişe patlamadan önce bir tıslama sesi çıkaracaktır. Tıslama olmaması flakonun güvenli olduğu anlamına gelmez. Kriyotüpleri ve ampulleri, azot tankından çıkarıldıktan hemen sonra otoklavlanabilir, ağır duvarlı bir kapta gazlı bez veya kağıt havluya yerleştirin ve ağır duvarlı kabın kapağını hızlı bir şekilde kapatın. Bir patlama meydana gelirse, tüm gemiyi otoklavlayın.
3.9.5. Embrittlement
- Kriyojenik sıvıları asla kanalizasyona dökmeyin. Laboratuvar sıhhi tesisatı, kriyojenik sıcaklıklarda kırılgan hale gelen ve kolayca kırılan birçok sıradan malzemeden biridir.
- Ahşap ve diğer gözenekli malzemeler düşük sıcaklıklarda oksijeni hapsedebilir ve mekanik şoka maruz kaldığında patlar (42).
3.9.6. Bulaşıcı hastalık tehlikeleri
- Sıvı azot, dewar'da ampuller kırıldığında kirlenebilir ve kirleticiler azotta korunabilir (23). Bu potansiyel olarak bulaşıcı kirleticiler, dewar'daki diğer şişeleri kirletebilir ve sıvı azot buharlaştıkça bulaşıcı bir aerosol oluşturabilir.
- Sıvı azot sıcaklıkları için derecelendirilen plastik kriyotüpler, sıvı azot depolaması için önerilir, çünkü cam ampullerden daha sağlam görünürler ve azotta kırılma olasılıkları daha düşüktür.
3.10. Kayma, Takılma ve Düşme Tehlikeleri
Kaymalar, takılmalar ve düşmeler, bir laboratuvar çalışanının bulaşıcı ajanlar veya tehlikeli kimyasallar içeren gemileri düşürmesine veya dökmesine neden olabilir. Ayrıca laboratuvar çalışanlarını LAI'lere karşı daha savunmasız hale getiren cilt delinmelerine ve sıyrıklara yol açabilirler.
İyi temizlik, kaymaları, gezileri ve düşmeleri azaltmak için en temel araçtır. İyi bir temizlik olmadan, diğer önleyici tedbirler (örneğin, sofistike döşeme, özel ayakkabı montajı veya yürüme ve güvenli düşme teknikleri üzerine eğitim) asla tam olarak etkili olmayacaktır.
3.10.1. Fişler
- Laboratuvar fişlerinin yaygın nedenleri arasında ıslak veya yağlı yüzeyler; gevşek, demirlenmemiş kilimler veya paspaslar; ve tüm alanlarda bir dereceye kadar çekişe sahip olmayan döşeme veya diğer yürüme yüzeyleri bulunur.
- Yerdeki su en büyük kayma tehlikesidir. Yerdeki suyu derhal temizleyin.
- Doku montajı ve kesiminden elde edilen parafin, doku işleme alanlarında birikebilir ve özel zemin bakımı önlemleri alınmadığı sürece düzenli temizliğe rağmen zeminin kaygan olmasına neden olabilir.
- Mineral yağlar, montaj sıvıları, paslanmaz çelik temizleyiciler ve diğer laboratuvar kimyasalları ve/veya reaktifler, yere inerlerse kayma tehlikesi yaratır. Bu tür dökülmeler keşfedilir keşfedilmez sabun ve suyla temizleyin.
- Zeminleri temizlemek için alkol kullanmayın; alkoller zemin mumunu çözerek farklı çekiş derecelerine sahip alanlar oluşturacaktır.
- Paspaslar, zemine düzgün bir şekilde sabitlenmedikleri takdirde kayma tehlikesi oluşturabilir.
- Kağıt, karton veya ambalaj malzemeleri üzerinde yürümek kayma tehlikesi oluşturabilir.
3.10.2. Geziler
- Açmanın yaygın nedenleri arasında engellenmiş görüş, zayıf aydınlatma, geçitteki dağınıklık, geçitteki paspaslar veya diğer öğeler, açık kablolar, açık çekmeceler veya dolaplar ve düzensiz yürüme yüzeyleri bulunur. Geçirgen paspaslar ve kilimler, bu bölümde daha sonra belirtilenler dışında, mikrobiyolojide önerilmemektedir.
- Erişildikleri zamanlar dışında çekmeceleri ve dolapları kapalı tutun.
- Diz deliği boşluklarından çıkıntı yapan dağınıklık ve eşyalar, işçilere koridorlarda hareket ederken zarar verebilir. Dağınıklığı minimumda tutun. Kutuların ve diğer eşyaların koridorlara çıkmadığından emin olun.
- Kordonları veya kabloları koridorlar veya diğer yürüyüş yolları arasında çalıştırmayın.
- Güvenlik görevlisi veya laboratuvar yönetimi, belirli bir laboratuvar alanında çalışmadan önce laboratuvarın diğer bölümlerinde ergonomik yorgunluk önleyici paspasların kullanımını değerlendirmelidir. Bu tür paspasları kullanmadan önce dikkat edilmesi gereken endişeler şunları içerir:
— Bu paspaslar biraz kalındır ve yükseltilmiş yüzey bir açma tehlikesi oluşturur.
— Paspaslar, arabalar ve sandalyeler için engellerdir ve devrilmelerine neden olabilir.
— Dökülme temizliğini zorlaştırırlar.
— Zeminlerin temizlenmesini ve dezenfekte edilmesini gözaltı personeli için zorlaştırırlar.
— Ayrıca, yanlışlıkla kimyasallar veya bulaşıcı ajanlarla kontamine olmuş paspasları alır veya taşırlarsa, gözaltı personelini riske atabilirler.
— Sıvılar genellikle paspasın altından fitler ve potansiyel kontaminasyon sorunlarını gizler.
— Paspaslar, acil bir durumda laboratuvardan çıkışı engelleyebilecek bir takılma/düşme tehlikesi sunar.
3.11. Ultra Düşük-Sıcaklık Dondurucular
Ultra düşük sıcaklıklarda depolanan eşyaları tutarken termal olarak dayanıklı eldivenler ve laboratuvar önlüğü giyin. Ultra düşük sıcaklıklarda depolanan örnekler aşırı soğuktur [-70°C ila -85°C]) ve paradoksal olarak ciltle doğrudan temas ciddi yanıklara neden olabilir.
3.12. Ultraviyole ışık
- Kısa dalga UV ışığı, bazı tip 1 su sistemlerinde terminal dezenfektan olarak floresan mikroskoplarda kullanım ve etidyum bromür lekeli jellerde nükleik asit bantlarını görselleştirmek de dahil olmak üzere laboratuvarda çeşitli uygulamalara sahip olmuştur.
- Kısa dalga UV ışığına maruz kalma cilt kanserleri, kornea skarlaşması ve cilt yanıkları ile ilişkilendirilmiştir. Bu etkiler doğrudan veya yansıyan UV ışığına maruz kalmaktan kaynaklanabilir (44).
- BSC'leri dekontamine etmek için UV ışıkları kullanmayın. Çatlaklardaki, gölgelerdeki ve ekipmanın alt tarafındaki organizmalar UV ışığı işleminden etkilenmez. Ayrıca, bu ışıkların ürettiği radyasyon ve ozon, BSC ve çevresinde plastik ve kauçuk maddelere saldırarak ömürlerini kısaltacaktır. Bu maruziyet mekanik pipet kalibrasyonlarını ve diğer hassas ekipman fonksiyonlarını etkileyebilir.
- BSC'lerde UV ışıklarının başka nedenlerle kullanılması gerekiyorsa, yoğunluk sensörleri ile bunları yaşamları boyunca izlemek için bir araç sağlayın. Kalibre edilmiş UVC sensörleri, BSC'lerde UVC radyasyon seviyelerini izlemenin güvenilir ve uygun maliyetli bir yoludur. Bu ışıkları izleyin çünkü mikrop öldürücü UV ışıkları yaklaşık 9.000 saatlik bir beklenen ömre sahiptir.
- 15 dakikadan daha uzun süre süren mikrop öldürücü UV ışınlaması ters etki yaratır, çünkü ek bir mikrop öldürücü fayda sağlamaz ve ekipman bozulmasını hızlandırır.
- Bir operatör kabinde çalışırken UV lambası asla açık olmamalıdır. Tüm koruyucu gözlükler laboratuvar çalışanlarını zararlı UV ışığına maruz kalmaktan korumaz. Koruyucu gözlüklerin UVC koruması için derecelendirildiğinden emin olun.
- Rutin lamba bakımı yaparken veya doğrudan veya dolaylı (yansıyan ışık) maruziyet için potansiyel varsa UV güvenlik gözlükleri takın.
- Koruyucu filtre kalkanları olmayan UV görünüm kutularıyla çalışırken eldiven, uzun kollu laboratuvar önlüğü ve tam yüz kalkanı giyin.
- UV ışığının kullanıldığı alanlarda, "Dikkat, Ultraviyole Işık, Koruyucu Gözlük Takın" yazılı pankartlar sergileyin.
3.13. Vakum cihazları
Genel laboratuvarda vakum destekli filtrasyon cihazları ve yan kol emme şişeleri rutin olarak kullanılırken, elektron mikroskobu laboratuvarı vakum destekli buharlaştırıcılar, donma-kurutucular, donma-kırık ve püskürtme kaplayıcı üniteleri kullanır. Vakum destekli cihazlar, patlama tehlikeleri ve aerosol üretimi riski sunar.
3.13.1. İmplozyon güvenliği
- Basınç farkı kabın spesifikasyonlarını aştığında patlamalar meydana gelebilir.
- Patlamalar keskin cam kalıntılarını her yöne saçabilir ve civardaki herkesi ciddi şekilde yaralayabilir (42,43). Ayrıca damarda bulunan tüm bulaşıcı ajanları da dağıtacaklar.
- Ağır duvarlı, yan kollu emme şişeleri genellikle bir atmosferin (14.7 PSI) basınç farkına dayanacak şekilde derecelendirilmiştir; bu seviyeyi aşan basınç farkları sağlayan ev vakum sistemleri veya vakum pompaları, bir sıralı basınç regülatörü ile düzenlenmelidir.
- Vakum şişeleri ve çan kavanozlarındaki çatlaklar, talaşlar ve çizikler, uygun diferansiyeller basınç regülatörleri tarafından sağlandığında bile camı zayıflatabilir ve patlamaya neden olabilir.
- Aşırı aşınma veya sert cisimlerle çarpmanın neden olduğu çan kavanozlarının ve emme şişelerinin zarar görmesini önlemek için özen gösterilmelidir.
- Plastik ağ veya plastik kutulardan yapılmış patlama koruyucuları, kabın arızalanması durumunda cam parçaları içerecek şekilde emme şişeleri ile birlikte kullanılmıştır. Enfeksiyöz ajanlar veya kan veya kan ürünleri işlendiğinde, plastik şişelerin kullanılması şiddetle tavsiye edilir.
3.13.2. Aerosol üretimi
- Vakum destekli aspirasyon tuzakları, vakum pompasının veya ev vakum sisteminin kontaminasyonunu önlemek için sıralı bir HEPA filtresi (örneğin, Vacushield Vent Cihazı, Pall Life Sciences, Port Washington NY veya eşdeğeri cihaz) ile seri olarak bir araya getirilmiş bir veya iki emme şişesinden oluşur (1).
- Özel bir vakum pompası kullanırken, birçok laboratuvar ayrıca kaba Drierite (W.A. Hammond Drierite Co., Ltd, Xenia, OH) veya havadaki nemi gidermek ve böylece pompayı korumak için eşdeğer bir kurutucu madde. Aspirasyon tuzakları, yeniden beslemeden veya diğer hücre manipülasyonlarından önce kültür ortamlarını tüplerden, kabuk flakonlarından ve diğer damarlardan çıkarmak için virolojide kullanılır. Aspirasyon sistemleri ayrıca enzime bağlı immünoassay (ELISA) plaka yıkayıcılarda da kullanılmaktadır.
- Tüm bu cihazlar, sıvıyı çalkalayarak ve sıvı yüzeyini azaltılmış basınç altına yerleştirerek aerosol üretir (23). Aerosoller enfeksiyöz ajanları hemen yüzeylerde biriktirebilir ve daha ince aerosoller solunabilir.
3.13.3. Aerosol koruma önlemleri
- Herhangi bir aerosol içermek için bir BSC'de aspirasyon cihazları kullanın.
- Operatörler, kendilerini bulaşıcı damlacıklardan korumak için tek kullanımlık bir laboratuvar önlüğü ve eldiven giymelidir.
- Bir kültür aspirasyonu tamamlandığında, havadaki aerosolleri temizlemek için BSC üfleyicinin 5 dakika çalışmasına izin verin; çalışma yüzeylerini normal şekilde dekontamine edin.
- Hat içi HEPA filtreleri her 6 ayda bir veya ıslandığında veya gözle görülür şekilde tıkandığında değiştirin.
3.13.4. Sıvı atıkların vakum destekli aspirasyon tuzaklarından bertarafı
- Asla bulaşıcı atıkları lavaboya dökmeyin.
- Aspirasyon tuzaklarından sıvı atıkları bertaraf etmeden önce çamaşır suyu ile dekontamine edin.
- Bireysel bir vakum pompasına bağlı bir aspirasyon kapanı kullanırken, laboratuvarlar genellikle pompayı klor buharı korozyonundan korumak için buharları aktif bir kömür tuzağından geçirir.
- Çeşitli emme kapanı konfigürasyonları mümkündür ve nihai yapılandırma, iş akışına ve bireysel laboratuvar uygulamalarına bağlı olacaktır. Aşağıdaki prosedürler tüm konfigürasyonlar için geçerlidir.
— Aşırı doldurmayı önlemek için vakum şişelerini dörtte üçü dolu olduğunda değiştirin. Bazı laboratuvarlar, şişe üzerinde maksimum doldurma hacmini işaretlemeyi ve aspire edilen sıvılar maksimum dolum işaretine ulaştığında 1:10'luk bir ağartma çözeltisi üretmek için günün başında yeterli miktarda ağartıcı eklemeyi tercih ediyor.
— 10-15 mL yeni yapılmış bir ağartıcı çözeltisini tuzağa aspire ederek hortumu dezenfekte edin. Tüm çamaşır suyunun tuzağa girmesine izin vermek için hortumu kaldırın. 20 dakika bekleyin, ardından tuzağı BSC'den çıkarın.
— Dekontamine edildikten sonra, sıvı bulaşıcı değildir ve sıhhi kanalizasyona dökülebilir.
Viroloji laboratuvarı için not: Ağartıcı, hücre kültürü ortamındaki fenol kırmızı boyasını azaltacak ve çözelti kırmızıdan renksize gidecektir. Bu renk değişikliği olmazsa, sıvı dekontamine edilmemiştir ve damarı dekontamine etmek için yeterli miktarda ağartıcı eklenmelidir.
3.14. Biyolojik Tehlikeler
3.14.1. Delinmeler ve kesikler
Deri delinmeleri ve kesikleri doğrudan bulaşıcı bir ajanı vücuda sokabilir ve ikincil bir ajanın girebileceği bir yol sağlayabilir.
- İğne çubukları (45)
— Klinik laboratuvarlar bir iğne ve kesici alet yaralanma önleme programı oluşturmalıdır.
— İğne ve şırınga kullanımını alternatif yöntem bulunmayan prosedürlerle sınırlayın. İğne sopması yaralanmaları en sık iğneler kullanımdan sonra koruyucu kılıflarına geri döndüğünde ortaya çıkar.
— İğneleri yeniden ısıtmayın. Yeniden kılıflama kesinlikle gerekliyse, prosedür yaralanmayı ve kazara aşılamayı en aza indirmek için bir iğne yeniden kesme cihazı kullanmalıdır.
— İğne kesme cihazları kullanmayın çünkü bunlar bulaşıcı aerosoller üretebilir. Kullanımdan sonra, iğneleri ve şırıngaları, "Biohazard" kelimesi ve dekontaminasyon ve bertaraf için evrensel biyolojik tehlike sembolü ile uygun şekilde etiketlenmiş sızdırmaya ve delinmeye dayanıklı kaplara yerleştirin.
— Tek kullanımlık şırıngalardan iğneleri bükmeyin, kesmeyin, yeniden düzenlemeyin veya çıkarmayın veya atmadan önce elle manipüle etmeyin.
— Donmuş bölümleri kesmek için kullanılan mikrotom/kriyostat bıçakları, dikkatli bir şekilde ele alınması gereken başka bir potansiyel keskinliktir. Temizlik ve dezenfeksiyon için potansiyel olarak kirlenmiş bıçağın sökülmesi sırasında kesilmeye dayanıklı eldivenler giyin. - Kırılma
— Kırık camları asla eldivenli veya çıplak ellerle almayın. Kırık camı almak için forseps, tek kullanımlık plastik kepçeler, maşa veya hemostat kullanın; kırık camı bir kesici alet kabına atın. Kirlenmemiş cam eşyaları almak için çeşitli laboratuvarlara veya yardımcı dolaba bir süpürge veya el fırçası ve fara yerleştirin.
— Kırık veya yontulmuş cam eşya kullanmayın. Kırık cam eşyalar için etiketlenmiş uygun kesici kap kabına atın.
— Dökülen bulaşıcı maddelerle kırık kapları tutarken, aşağıdaki yönergelere uyun (1).-
Bu prosedür için uygun eldiven giyin (risk değerlendirmesi ve gerekli korumaya dayalı olarak).
-
Kırık kabı ve dökülen bulaşıcı maddeyi bir bezle veya kağıt havlularla örtün.
-
Rutin BSL-2 laboratuvarı için, kapalı alanın üzerine bir dezenfektan veya taze 1:10 ev tipi çamaşır suyu çözeltisi dökün ve en az 20 dakika bekletin.Odada saatte 12 oda havası değişimi olsaydı, havadaki M. tüberkülozun havasını %99 çıkarma verimliliğinde bir dökülmeden temizlemek 23 dakika ve bu çıkarma için %99,9 verimlilikle 35 dakika sürer (46). Teşhis laboratuvarlarında saat başına oda havası değişimlerinin sayısının değişkenliği göz önüne alındığında, bekleme süresi dikkatlice değerlendirilmelidir.
-
Bez veya kağıt havlular ve kırık malzeme biyolojik tehlike kesici kaplara temizlenmelidir. Cam parçaları eldivenli ellerle değil, forseps ile ele alınmalıdır. (Porseps ile pamuk bant kullanmak bu prosedürü kolaylaştırır). İnce cam partiküllerin uzaklaştırılması için küçük HEPA elektrikli süpürgeler de mevcuttur.
-
- Laboratuvar formları veya diğer basılı veya yazılı maddeler kontamine olursa, formlar veya yazılı madde üzerindeki bilgiler başka bir forma kopyalanacak ve orijinal biyolojik tehlike atık kabına atılacaktır.
- Pastör pipetleri
— Mümkün olduğunda, daha yeni veya daha iyi bir tekniğin mevcut olup olmadığını belirlemek için plastiği değiştirin veya prosedürü değerlendirin.
— Pasteur pipetinin hem üst hem de alt kısmı delinme yaralarına neden olabilir.
— Bir cam Pasteur pipeti tutmadan önce, kırık veya çatlamış olup olmadığını görmek için pipetin üstünü inceleyin. Kırık pipetler delinme yaraları üretebilir.
— Cam Pasteur pipetleri emme hatlarına yerleştirirken, pipeti üstte tutun ve elinizin ucun altına uzanmasına izin vermeyin. Pipeti oturturken uygunsuz teknik, el kayarsa veya pipet kırılırsa delinme yaralarına neden olabilir.
— Kullanılmış Pasteur pipetlerini sızdırmaz ve delinmeye karşı dayanıklı kaplara atın. Çoğu yerde, kontamine Pasteur pipetleri keskin kabul olarak kabul edilir ve bu şekilde atılmalıdır. - Diğer keskin cihazlar
— Testten önce doku örneklerini ayırmak için bıçaklar, makaslar ve doku homojenizatörleri sıklıkla kullanılır. Bu maddeler, laboratuvar çalışanlarına bulaşıcı materyallerle zarar verebilecek veya aşılayabilecek kesikleri ve deri delinmelerini önlemek için dikkatli bir şekilde kullanılmalıdır.
— Sivri forseps genellikle ince ayrışma için ve kabuklu flakonlardan kapakları çıkarmak için kullanılır. Bu forsepsler, dikkatsiz kullanıcıyı delerek yaralanmaya ve/veya enfeksiyona neden olabilir.
— Cam slaytlar cildi kırabilir ve delebilir.
— Kültür tüpleri ve kabuk şişeleri, kapaklar zorlanırsa çatlayabilir veya parçalanabilir. Ortaya çıkan parçalar lateks eldivenlere ve cilde kolayca nüfuz edebilir.
— Cam kapların dudağı yontulabilir ve bu yontulmuş yüzeyler ihtiyatsız laboratuvar çalışanlarını kesebilir. Yontulmuş cam eşyaları ilk fırsatta atın. - Sharps imhası
— Kullanılmış tek kullanımlık iğneleri, şırıngaları, neşterleri, bıçakları, pipetleri ve benzeri nesneleri, bertaraf edilmek üzere yapılmış uygun şekilde etiketlenmiş sızdırmaya ve delinmeye karşı dayanıklı kaplara dikkatlice yerleştirin. Çoğu yetkili, iğnelerin ve şırıngaların, kullanılıp kullanılmasın, bu tür kesici kaplara atılmasını şart koşar.
— Çevresel kirlenmeyi ve üretim noktasında keskinlerin biriktirilmesi ve keskinlerin bir yerden başka bir yere taşınmasıyla ilgili yaralanmaları önlemek için keskin atların kullanıldığı alanda veya yakınında kesici atma kaplarını bulun
— Üçte iki ila dörtte üç dolu olan keskin uçlu kapları değiştirin. Sharps konteynerleri, dekontaminasyon alanlarına taşıma için güvenli bir şekilde kapanmalıdır. Laboratuvar personeli dolu konteynerleri zorla kapatmaya çalıştığında yaralanmalar meydana gelebilir. Fazla doldurulmuş kaplar tekrar açılabilir ve diğer çalışanlar için tehlike oluşturabilir.
— Tek yapılmayan kesicileri, tercihen otoklavlama yoluyla (1) dekontaminasyon için bir işleme alanına taşımak üzere kapalı, sızdırmaz, sert duvarlı bir kaba yerleştirin.
— Saha dışında dekontamine edilecek malzemeleri bir tıbbi atık nakliye konteynerine yerleştirin ve geçerli eyalet, yerel ve federal düzenlemelere uygun olarak nakliye için güvenli hale getirin (1).
— Temiz, kirlenmemiş kesicileri (örneğin, temiz kırık cam eşyalar, yontulmuş temiz pipetler) normal çöp akışında atılmak üzere sert, delinmeye dayanıklı kaplara koyun. Kazara açılmayı ve olası yaralanmaları önlemek için kapları bantlayın.
— Keskin eşyaları asla doğrudan normal çöp kutusuna koymayın. Çöp torbaları sert çöp konteynerlerinden çıkarıldığında gözaltı görevlilerine veya diğer personele zarar verebilirler.
3.14.2. Enfeksiyöz ajanlarla yutma ve temas
- Laboratuvardayken gözlere, buruna, ağza ve dudaklara dokunmaktan kaçının.
- Ağıza veya dudaklara kalem, kurşun kalem, koruyucu gözlük veya diğer laboratuvar malzemeleri koymayın.
- İnsan tüketimi için yiyecek ve içecekleri laboratuvarda saklamayın.
- Ağız pipetleme yasaktır; mekanik pipetleme cihazları kullanılmalıdır.
- Laboratuvarda yeme, içme, sigara içme, kontakt lens kullanma ve kozmetik uygulamasına izin verilmez.
- Potansiyel olarak tehlikeli maddelerle çalıştıktan sonra ve laboratuvardan ayrılmadan önce ellerinizi yıkayın. Laboratuvar, tercihen laboratuvar çıkışının yakınında bulunan el yıkama için bir lavaboya sahip olmalıdır.
- Elleri tehlikeli maddelere maruz kalmaktan korumak için eldiven giyilmelidir. Moleküler biyoloji alanında eldivenler de numuneyi ciltteki nükleazlardan korur.
— Eldivenleri kontamine olduklarında, bütünlükleri tehlikeye girdiğinde veya başka bir şekilde gerekli olduğunda değiştirin
— Tehlikeli maddelerle çalışma tamamlandığında ve laboratuvardan ayrılmadan önce eldivenleri çıkarın ve ellerinizi yıkayın.
— Tek kullanımlık eldivenleri yıkamayın veya yeniden kullanmayın.
— Laboratuvarda eldiven giyerken asla yüzünüze, ağzınıza, gözlerinize veya diğer mukoza zarlarınıza dokunmayın
— Teşhis laboratuvarında giyilen eldivenler potansiyel olarak kontamine olarak kabul edildiğinden, atarken bunları biyolojik tehlike imha kaplarına yerleştirin.
— Telefona cevap verirken veya bilgisayar gibi ortak ekipman kullanırken eldivenleri çıkarın. - Elvisiz ellerin kirlenmesini önlemek için laboratuvarı kolayca temizlenebilecek şekilde tasarlayın.
— İşin tamamlanmasından sonra ve potansiyel olarak bulaşıcı materyal dökülmesinden veya sıçramasından sonra çalışma yüzeylerini uygun bir dezenfektanla dekontamine edin (bkz. Bölüm 3.4, Dezenfeksiyon).
— Tezgah üstleri suya karşı dayanıklı ve ısıya, organik çözücülere, asitlere, alkalilere ve diğer kimyasallara karşı dayanıklı olmalıdır.
— Laboratuvar çalışmalarında kullanılan sandalyeler, kolayca temizlenen gözeneksiz bir malzeme ile kaplanmalıdır. Açık bez sandalyeler uygun değildir. - Telefonlar, enfeksiyöz ajanları yüz ve mukoza zarlarına aktarmak için potansiyel bir araçtır ve bunu akılda tutarak kullanılmalıdırlar.
— Eldivenli ellerle bir telefonu asla açmayın veya çevirmeyin.
— Telefonları düzenli olarak dezenfekte edin. (Alkoller, zarfsız virüsleri inaktive etmez veya DNA'yı yok etmez.)
— Telefon ahenin yüzüne dokunmamak için mümkün olduğunda eller serbest veya hoparlörlü telefon özelliklerini kullanın. - Laboratuvara asla evrak çantaları, cüzdanlar, sırt çantaları, kitaplar, dergiler ve diğer kişisel eşyaları getirmeyin. Bu eşyaların dezenfekte edilmesi zordur.
3.14.3. Cilde ve mukoza zarlarına düşer ve sıçrar
- Tüm prosedürleri sıçrama ve aerosol oluşumunu en aza indirecek şekilde gerçekleştirmek tüm laboratuvar çalışanlarının sorumluluğundadır.
- Göze tüm sıçramalar en az 15 dakika boyunca yıkanmalıdır. Kontakt lens takan bir laboratuvar çalışanı göze bir sıçrama alırsa, göz suyla yıkanmalı, lens çıkarılmalı ve göz tekrar yıkanmalıdır. Tek kullanımlık kontakt lensleri atın. Yeniden kullanılabilir kontakt lensleri göze geri döndürmeden önce dezenfekte edin. Üreticiye danışma garanti edilebilir.
- Laboratuvarda kullanılan numune kapları, kültür tüpleri, kabuk flakonları ve diğer silindirik kaplar kolayca yatılır ve tezgah üstüne yerleştirildiğinde yuvarlanabilir. Cam kaplar düşerse kırılabilir. Kırılma fırsatlarını önlemek için mümkün olduğunda bu gemileri raflara sabitleyin.
3.14.4. Aerosoller ve damlacıklar
Mikrobiyal süspansiyona enerji veren herhangi bir prosedür bulaşıcı aerosoller üretebilir (1,23). Aerosol üretimi ile sıklıkla ilişkili prosedürler ve ekipmanlar arasında pipetleme, bir pipet veya girdap karıştırıcı ile karıştırma ve karıştırıcıların, santrifüjleme ve ultrasonik cihazların (sonikatörler) (1,23,47) kullanımı yer alır. Bu prosedürler ve ekipman, uzun süre havada kalan solunabilir parçacıklar oluşturur. Solunduğunda, bu küçük parçacıklar akciğerlerde tutulabilir.
Bu prosedürler ve ekipman aynı zamanda daha büyük miktarlarda bulaşıcı ajanlar içerebilen daha büyük damlacıklar üretir. Daha büyük damlacıklar havadan hızla yerleşir, kirletici, çalışma yüzeylerinin yanı sıra eldivenli eller ve muhtemelen prosedürü gerçekleştiren kişilerin mukoza zarları.
Solunabilir parçacıklar nispeten küçüktür ve boyut dağılımında büyük ölçüde değişmez. Buna karşılık, el ve yüzey kontaminasyonu önemlidir ve büyük ölçüde değişir (1,48). Daha büyük boyutlu damlacıklara maruz kalmanın potansiyel riski, bir risk değerlendirmesinde, solunabilir parçacıklardan kaynaklanan risk kadar dikkat gerektirir.
- Pipetleme
Pipetler ve pipetleme işlemleri, bulaşıcı aerosoller ve çevresel kontaminasyon için kayda değer bir kaynak olabilir. Bu nedenle, bir BSC'de pipetleme yaparken eldiven, göz koruması ve örgü manşetli laboratuvar önlüğü giymek ve pipetleme işlemleri yapmak ihtiyatlıdır. Aşağıdaki kılavuzlar serolojik veya mekanik pipetler için olanlara kategorize edilmiştir.
— Serolojik pipetler. Son sıvı damlası pipet ucundan zorla dışarı atıldığında, elleri ve çevreyi kirletebilecek küçük ve büyük damlacık aerosolleri oluşur (23). Aerosol oluşumunu en aza indirmek için, pipet ucunu tüplerin, şişelerin veya diğer damarların iç duvarına yerleştirin ve son sıvı damlalarını nazikçe dışarı atın.
— Hücre kümelerini dağıtırken, virologlar örnekleri ve hücre süspansiyonlarını homojenleştirmek için sık sık pipetin içine ve dışına sıvı çekerler. Bu işlem sırasında, özellikle sıvı pipet ucundan zorla dışarı atıldığında önemli miktarda aerosolizasyon meydana gelebilir. Aerosoller, kültür seyreltmelerinin "pipet karışımı" sırasında benzer şekilde üretilir. Bu tip karıştırma için tercih edilen yöntem kapalı kapaklı girdap karıştırma yöntemidir. Pipet karıştırma gerekiyorsa, pipet ucunu sıvı yüzeyinin altında tutun ve tüm sıvı hacmini pipetten çıkarmayın. Bu, aerosolizasyonu ve kabarcık oluşumunu azaltacaktır.
— Güçlü pipetleme (sıvının pipete hızlı aspirasyonu) pipetler içinde aerosoller oluşturabilir. Aerosollerin bir kısmı, pipetin proksimal ucundaki pamuk tapa tarafından sıkışacaktır. Ancak bazı aerosoller pamuk tapasından geçip pipetleme cihazını kirletebilir. Bazı mekanik pipetleme cihazları, ahizenin kontaminasyonunu en aza indiren HEPA filtrelere sahiptir. Bu filtreleri düzenli olarak ve ıslandıklarında değiştirin. Pipet ampullerini düzenli olarak ve kontamine olduklarında dekontamine edin.
— Mekanik pipetler. Elde tutulan mekanik pipetleme cihazları, enzim immünoassay (EIA) testi, moleküler teşhis ve hassasiyet gerektiren diğer faaliyetler için kullanılır.
— Moleküler teşhiste, pipet kontaminasyonu yanlış pozitif sonuçların en sık nedenidir (49). Pipet kontaminasyonu aerosollerden, pipetin dışına temas etmekten kirlenmiş bir yüzeye ve pipetin içinin kirlenmesinden pipetleme işlemi sırasında meydana gelebilir.
— Uçta kalan son sıvının atılması damlacık sıçramasına ve aerosol oluşumuna neden olacaktır. Bu aerosoller ve damlacıklar diğer numuneleri ve çevreyi kirletebilir. Çoğu mekanik pipetleme cihazının pistonda iki durağı vardır - "Teslim Etmek" durağı ve "Expel" durağı. Pipet hacimleri, "Teslim Etmek" durağında doğruluk için kalibre edilir ve pipetleme doğruluğunu korumak için nihai sıvı miktarını dışarı atmaya gerek yoktur.
— Teslim pistonuna basmadan önce pipet uçlarını kuyucuk veya tüpün içine dokunun. Pipetleme akışını asla kuyunun ortasına yönlendirin çünkü bu sıçramaya ve kontaminasyona neden olur.
— Kullanılan uçları atılan kaplara çıkarırken dikkatli olunmalıdır, çünkü kalan sıvı geniş bir şekilde sıçrayabilir ve sıçrayabilir.
— Pipet namlusunun dışı, sıçrama, aerosoller veya namluya kontamine nesnelere dokunarak kirlenebilir. Pipetin namlusunu bir reaktif, numune kabına uzatmayın veya atmayın. Normal uzunluktaki uçlar tüpteki sıvıya ulaşamıyorsa, namlu kontaminasyonunu önlemek için genişletilmiş erişimli pipet uçlarını kullanın.
— Mekanik pipetleri üreticinin talimatlarına uygun olarak düzenli olarak veya 1:10 ev tipi çamaşır suyu seyreltmesi ve ardından mümkün olduğunca fazla çamaşır suyunu çıkarmak için %70 alkol ile dezenfekte edin.
— Aerosole dayanıklı pipet uçlarının kullanılması, pipetin içindeki nükleik asit kontaminasyonunu önemli ölçüde azaltabilir. Aerosol-resistant uçlar, pipet ucunun duvarlarına yapıştırılmış hidrofobik mikro gözenekli bir filtre içerir. Mikro gözenekli filtre, aerosolleri pipetin namlusunu kirletmeden önce hapseder. Bu filtreler ayrıca, kirlenmiş bir pipet yanlışlıkla kullanıldığında numunenin kontaminasyonunu da önleyebilir (49).
— Bir pipet ucundan kazara düşen bir damla sert bir yüzeyle karşılaştığında, aerosoller ve bazıları düşecek ve işlemi tekrarlayacak kadar büyük olabilecek bir dizi küçük damlacık oluşturur (50). Damlalar sert bir yüzeye daha uzun bir mesafe düştüğünde daha fazla kirlenme ortaya çıkar.
— Birçok laboratuvar, düşen damlalardan kaynaklanan kontaminasyonu içermek veya emmek için BSC'lerde ve laboratuvar çalışma tezgahlarında ticari plastik destekli tezgah kağıdı kullanır.
— Düşen bir damlanın kaçınılmazlığı ile karşı karşıya kaldığında, pipetin ucunu indirmek ve damlanın emici bir havlunun üzerine kısa bir mesafe düşmesine izin vermek en iyisidir. Bu prosedür, damlanın kinetik enerjisini ve sıçrama kapasitesini en aza indirecektir. - Tüpler ve diğer kaplar
— İnce filmler bazen kültür tüplerinin, kabuk flakonlarının, mikrosantrifüj tüplerinin, numune şişelerinin ve diğer kapların boynunda oluşur. Bu filmi kırmak veya patlatmak, bulaşıcı ajanlar, nükleik asitler veya diğer potansiyel kirleticiler içerebilen aerosoller ve mikro damlacık sıçraması üretir (23).
— Boyunda ince filmler bulunan kaplar, filmi parçalamak veya damardaki sıvıyla birleşmesine neden olmak için mümkün olduğunda yeniden kaplanmalı ve santrifüjlenmelidir.
— Santrifüjleme mümkün değilse (örneğin, kültür şişeleri ile), açıklığın üzerine gazlı bez veya başka bir emici malzeme yerleştirin ve filmi bozmak için şişeye bir pipet yerleştirin. Pipeti ve emici malzemeyi diğer kirlenmiş malzemelerle atın.
— Mikrosantrifüj ve diğer fişli tüpler genellikle açıldığında aerosoller ve sıçrama üretecektir. Vidalı kapaklı mikrosantrifüj tüpler bu riski azaltabilir.
— Kapaktaki sıvı miktarını en aza indirmek için, mikrosantrifüj tüplerini açılmadan önce hızlı bir "darbe" santrifüjüne tabi tutun.
— Mümkün olduğunda bir BSC'de mikrosantrifüj tüplerini açın.
— Plug-seal mikrosantrifüj tüplerini açarken, oluşabilecek herhangi bir sıçramayı yakalamak için tüpün üstünü emici malzeme (örneğin, alkolle nemlendirilmiş gazlı bez) ile örtün. Emici malzemeyi diğer kontamine malzemelerle birlikte atın. - Liyofilize malzemeler, serum flakonları ve ampuller
Dondurularak kurutulmuş (liyofilize) malzemeden şişelerin açılması tehlikeli olabilir çünkü bu ince kuru tozlar, hava tahliye edilen kaba aktığında atmosfere kolayca dağılır (23). Liyofilize materyal içeren bir serum flakonunu güvenli bir şekilde açmak için aşağıdaki prosedür kullanılabilir.
— Flakonu ve önerilen seyrelticiyi (uygun olduğu şekilde su veya ortam) bir BSC'ye taşıyın.
— Liyofilize flakonları açarken eldiven ve laboratuvar önlüğü giyin.
— Flakondaki alüminyum kıvrımları çıkarmak için bir hemostat kullanın. Kıvırma malzemesini kesici kabına atın.
— Tıpayı nemli bir gazlı bezle örtün ve tıpanın kenarını dikkatlice kaldırın ve havanın flakona yavaşça girmesine izin verin. Flakonun içeriğini rahatsız etmeyin.
— Vakum serbest bırakıldıktan sonra, tıpayı tamamen çıkarın ve emici kağıda baş aşağı yerleştirin.
— Steril bir pipet kullanarak flakona uygun miktarda seyreltici ekleyin.
— Tıpayı değiştirin ve flakon içeriğinin birkaç dakika nemlenmesine izin verin.
— Gazlı bez, tıpa ve emici kağıdı diğer kirlenmiş malzemelerle birlikte atın.
— Bir pipet kullanarak flakonun içeriğini uygun bir kaba aktarın.
— Orijinal flakonu diğer kontamine malzemelerle birlikte atın.
— Serum flakonlarından bulaşıcı ajanları çıkarmak için iğne ve şırınga yöntemleri, çevreyi kirletebilecekleri ve iğne bağı yaralanmaları için fırsatlar sağladıkları için önerilmemektedir. Santrifüj taşıyıcılarına sıkışmış serum ayırıcı tüpleri çıkarmak için iğneleri değil forseps kullanın. - Cam ampuller
— Cam ampuller açıldıktan sonra kesik ve delinme riski oluşturabilir.
— Emniyetli ampul kırıcılar, kırma işlemi sırasında ampulü kapatarak yaralanmaları önleyebilir.
— Enfeksiyöz madde içeren ampuller için, skor çizgisini dezenfektanla nemlendirilmiş gazlı bezle örtün; ardından güvenlik ampulü kesiciyi kullanarak her zamanki gibi kırın.
— Ampul kırıcıyı, ampulü çıkardıktan sonra 1:10 ağartıcı çözeltisi içeren bir beher içine yerleştirin.
3.15. Ultrasonik Cihazlar
- Ultrasonik cihazlar esas olarak bakteri ve virüsleri parçalamak ve cam eşya ve laboratuvar ekipmanlarını temizlemek için kullanılır.
- Aerosol oluşumunu en aza indirmek için en düşük etkili güç ayarını kullanın.
- Cihaz kullanımdayken banyo sonikatörlerini örtün.
- Enfeksiyöz ajanların aerosolleşmesini önlemek için ultrasonik temizlemeye yönelik eşyalar temizlenmeden önce uygun şekilde dekontamine edilmelidir (23).
- Organizma lizis ve homojenizasyon prosedürlerini daima kapalı kaplarda gerçekleştirin.
- Banyoda bulunan bakteri ve mantar kirleticilerinin aerosolleşmesini önlemek için banyo sıvılarını sık sık değiştirin.
3.16. Laboratuvarın Temiz ve Kirli Alanları
Mikrobiyoloji laboratuvarında bölümün tüm teknik çalışma alanları kirli kabul edilir. Bu bölümde anlatýlan moleküler test alanlarýnýn ayný sýnýr çýkma ve ayrýlmasý kavramlarý, taný laboratuvarýnýn diðer bölümlerinde temiz ve kirli alanlarýn oluþturulmasunda kullanýlabilir.
3.16.1. Temiz alanlar
- Laboratuvarın temiz ve kirli alanlarında farklı renkte laboratuvar önlükleri giyin (temiz alanların girişinde bulundurun) veya temiz alanlarda laboratuvar önlüğü gerektirmez.
- Yeni oldukları bilinmedikçe temiz alana getirilen yeniden kullanılabilir malzemeleri ve cihazları (örneğin telefon, saatler, bilgisayarlar, kağıt mendil kutuları, çalışma kitapları) dekontamine edin ve hemen laboratuvar tarafından belirlenmiş, renk kodlu bant uygulayın.
- Çalışma kitapları, kağıt mendil kutuları ve kalemler gibi küçük nesneler üzerinde görsel bir hatırlatıcı, temiz bir alana yerleştirilmiş öğeleri kolayca tanımlayabilir.
- Temiz/kirli alan sınırlarını açıkça belirtmek için kirli ve temiz zemin alanlarının bantla (bant zemin temizliğine dayanmalıdır) ayrılmasını sınırlandırın.
- Temiz alanları temizlemek ve korumak için bir politika geliştirin.
- Tüm personeli (servis personeli dahil) temiz alanların nasıl tanımlanacağı ve sürdürüleceği ve sınır belirleme bandının ve diğer alan tanımlama araçlarının önemini tanıma konusunda eğitin.
- Temiz alanların kullanımı ve bakımındaki eğitimi belgeleyin ve yetkinliği değerlendirin.
3.16.2. Ofisler
Klinik laboratuvara açılan ofisler (örneğin, denetçiler ve laboratuvar direktörü) laboratuvar içindeki hibrit alanları temsil eder. Bu ofisler tipik olarak kolay veya verimli dezenfeksiyona izin verecek şekilde tasarlanmaz veya bakımı yapılmaz.
- Tüm ofis ve çalışma alanlarında el dezenfektan jeli tedarik edin ve jeli sık sık kullanın.
- Ofislerin temiz kalması gereken ancak gözden kaçabilecek bileşenleri şunları içerir:
— laboratuvar belgeleri, raporları ve kayıtları; küçük ekipman; kalemler; prosedür kılavuzları ve laboratuvarda bulunan ve eldivenli ellerle elle alınabilecek diğer öğeler;
— dezenfekte edilmesi zor halılar ve sandalyeler;
— laboratuvara alınabilecek veya laboratuvar dışında kullanılmak üzere alınabilecek kitaplar, dergiler ve diğer referans materyalleri;
— dezenfekte edilmesi zor olan ve genel laboratuvarda izin verilmeyecek kişisel eşyalar (örneğin fotoğraflar, ödüller, evrak çantaları, paltolar, botlar, sırt çantaları, cüzdanlar, kişisel elektronik cihazlar); ve
— gıda maddeleri. - Ofis alanlarını "temiz" olarak belirlemek, özellikle potansiyel olarak kontamine olmuş öğeler ofise getirildiğinde ve referans materyalleri ve belgeler ofis ve laboratuvar arasında serbestçe taşındığında, onları mutlaka kirletmez veya tutmaz. Aşağıdaki prosedürler laboratuvar ofis alanlarında kontaminasyon riskini azaltmaya yardımcı olabilir.
— Örnekleri, kültürleri, yeterlilik örneklerini ve benzer öğeleri asla ofis alanlarına getirmeyin.
— Ofislere girmeden önce KKD'yi çıkarın ve bu alanlara girmeden önce ellerinizi yıkayın.
— Kişisel eşyalar (ör. cüzdanlar, evrak çantaları ve benzeri ürünler) için özel ve korumalı bir temiz alan oluşturun.
— Ofis alanlarında masaları ve kişisel çalışma alanlarını, telefonları ve bilgisayar klavyelerini düzenli olarak dezenfekte edin.
— Ofis alanlarındayken gözlere, buruna, ağza ve dudaklara dokunmaktan kaçının.
— Ağza veya dudaklara kalem, kurşun kalem, gözlük fiyonk veya diğer eşyaları koymayın.
— Ofis alanlarında kozmetik uygulamayın veya izin vermeyin.
— Yiyecekleri ofiste saklamayın.
— Ofiste çalıştıktan sonra ve dinlenme odaları, idari alanlar, kafeterya ve kütüphane gibi ortak alanlara girmeden önce ellerinizi yıkayın.
— Ofis alanlarındaki dağınıklıktan mümkün olduğunca kaçının. Kutular, kağıtlar ve diğer öğeler ofisin temizlenmesini ve dekontamine edilmesini zorlaştırır.
— Laboratuvar yöneticileri ve denetçileri, laboratuvarın kirli alanlarında laboratuvar belgelerinin ve referans materyallerinin kullanımıyla ilişkili maruziyet risklerini değerlendirmekten ve bu riskleri en aza indirmek için kullanım politikaları geliştirmekten sorumludur.
3.16.3. Kirli alanlar
- Tüm ekipman, klavyeler, atıklar ve yüzeyler dahil olmak üzere çalışma laboratuvarının tüm alanları "kirli" alanlar olarak kabul edilir.
- Laboratuvarın kirli alanlarındaki çalışma prosedürlerini tanımlayan hiçbir standart mevcut değildir. Laboratuvarcılar, bu alanlardaki maddelere dokunarak bir etiyolojik ajanı bulaştırma potansiyelini veya riskini tanımada uyanık olmalıdır.
3.17. Enstrümantasyon
Otomatik veya manuel olsun, numune aerosolleri ve damlacıkları üretme potansiyeline sahip prosedürler (örneğin, stoper çıkarma, vorteksleme, tahliye edilmiş tüpleri açma veya delme, otomatik numune dağıtıcıları kullanılarak) bulaşıcı ajanlara maruz kalmayı önlemek için tasarlanmış KKD ve mühendislik kontrolleri gerektirir.
3.17.1. CO inkübatörlerinde su banyoları ve su (nemlendirme) tavaları
- Suya dezenfektanlar eklense bile düzenli olarak temizleyin.
- Biyoyükü azaltmak için, gerektiğinde suya fenolik deterjan, fungisitler veya yosun öldürücüler gibi dezenfektan ekleyin. Mikroorganizmaların büyümesini önlemek için sodyum azit kullanmaktan kaçının çünkü belirli metallerle patlayıcı bileşikler oluşturur.
- Dekontaminasyon amacıyla sıcaklığı haftada bir kez 30 dakika boyunca 90°C veya daha yüksek bir süre yükseltin.
- Bir dökülme veya kırılmadan hemen sonra temizleyin.
- CO inkübatörlerindeki su banyoları ve nemlendirme tavaları, su banyosu kapağı veya inkübatör kapıları açıldığında aerosol hale gelen bakteri, alg ve mantarları barındırabilir. Bu aerosoller kültürleri ve çevreyi kirletebilir.
- Organizma birikimini ve çıkarılması zor olan biyofilmlerin üretimini en aza indirmek için düzenli olarak boş ve temiz su banyoları ve nemlendirme tavaları.
3.17.2. Santrifüjler ve sitosantrifüjler
- Santrifüjler, uygun şekilde temizlenmez, bakımı yapılmaz ve çalıştırılmazsa son derece tehlikeli araçlar olabilir. Laboratuvar personeli santrifüj işlemi ve santrifüjle ilgili tehlikeler konusunda eğitilmelidir.
- Santrifüjlerin üretimini düzenleyen mevcut düzenlemeler, rotor hala dönerken kapağın açılmasını önleyen kapak kilitlerinin takılması, dengesizlik dedektörleri ve rotor aşırı hızını önleyen cihazlar ve inşaat malzemelerinin herhangi bir rotor arızasına dayanabilmesini sağlar. Bu korumaları olmayan eski santrifüjler son derece dikkatli çalıştırılmalıdır ve laboratuvarlar, bu özel tehlikeleri azaltmak için özel olarak çalıştırma talimatları sağlayan risk değerlendirmelerine ve işletme kılavuzlarına sahip olmalıdır.
- Her bir santrifüj tipinin bir kullanım kılavuzu olmalıdır.
- Operatörler, çalıştırdıkları her santrifüj türü hakkında belgelenmiş eğitim ve yetkinlik değerlendirmelerine sahip olmalıdır. Her santrifüj tipi için belgelenmiş talimat, uygun cihaz başlatma ve kapatma, acil durum prosedürleri ve kapatma, tüplerin dengelenmesi, güvenlik kapları ve kapaklarının kullanımı, rotor ve konteyner seçimi, yüksek hızlı ve ultra santrifüjler için gereksinimler ve konteyner dolum yüksekliği sınırlamalarını içerir.
- Tüm yüksek hızlı ve ultra santrifüjleri, yanlarda en az 6 inç ve santrifüjün arkasında 4 inç boşluk ile sabit, rezonanssız bir yüzeyde (zemin, tezgah üstü veya ağır masa) çalıştırın.
- BSL-2 veya daha yüksek alanlarda, rotorlar aerosol muhafazasına ("O-ringler") ve contalı güvenlik kaplarına ihtiyaç duyar.
- Bir BSC'deki rotorları, özellikle viroloji ve mikobakteriyoloji bölümlerinde yükleyin ve boşaltın.
- Santrifüjlerin ve özellikle rotorların kullanımı ve bakımı için üretici talimatları, rotor arızasıyla ilişkili ciddi tehlikeleri ve potansiyel maruziyetleri önlemek için kesinlikle uygulanmalıdır. Rotorları özel bir temiz alanda ve üretici tarafından belirtilen bir ortamda saklayın.
- Her vardiyanın sonunda ve döküldükten hemen sonra santrifüjleri temizleyin.
- Görünür kan veya vücut sıvısı dökülmeleri ile santrifüjleri asla çalıştırmayın.
- Rotorlar yıllık stres testine ve eksiksiz bir sertifikalı analize ihtiyaç duyar; çoğu santrifüj üreticisi bu hizmeti sunmaktadır.
- Tüm kullanıcı adlarını, çalışma tarihlerini, süreleri, hızları, toplam rotor devirlerini ve rotor durumuyla ilgili notları içerecek şekilde her yüksek hızlı ve ultra santrifüj rotor için eksiksiz ve kapsamlı bir rotor günlüğü tutun.
- Yıllık bir stres testinin (Magnaflux [Glenview, IL] veya diğer profesyonel olarak tanınan analizlerden) yapısal kusurların olmadığını kanıtladığı durumlar dışında, üreticilerin önerilen devirlerden veya hizmet yıllarından sonra (hangisi önce gelirse) rotorları emekli edin. Bu etkinlik için uzun vadeli bütçe planlaması önemlidir.
- Normal operasyonlar sırasında, yüksek hızlarda santrifüjleme havalandırma limanlarından gelen hava sorunları ve hava akışında bulunan bulaşıcı parçacıklar hızlı ve geniş bir şekilde dağılacaktır (47).
- Santrifüjleme sırasında tüp kırılması, büyük aerosol bulutları üretildiği için en büyük kontaminasyon riskini oluşturur. Contalı güvenlik kapakları olmayan tüpleri santrifüjlerken gizli kontaminasyon meydana gelebilir.
- Tüplerin etrafında akan hava akışı, vidalı tüplerin dişlerinden sıvı çekebilen bir venturi etkisi yaratabilir. Yüksek hızlı hava akışı, tüpün dışında bulunabilecek kurutulmuş veya sıvı malzemeleri de aerosolize edebilir.
- Contalı santrifüj güvenlik kaplarının ve sızdırmaz rotorların tutarlı kullanımı, bulaşıcı veya potansiyel olarak bulaşıcı malzemelerin santrifüjlenmesiyle ilişkili riskleri önemli ölçüde azaltabilir.
- Santrifüj içindeki arızaları ve aerosolleri önlemek için santrifüj ekipmanı uygun şekilde muhafaza edilmelidir.
- Santrifüj malzemeleri, delinmeye dayanıklı eldivenler, cımbız veya forseps, pamuk, hemostat, süpürge, el fırçası ve faraş ile uyumlu bir dezenfektan içeren bir santrifüj dökülme kiti sağlayın.
- Bir santrifüjdeki plastik vidalı teneke kutu veya kova içinde bir numune tüpü kırılırsa, aşağıdaki adımları uygulayın.
— Motoru kapatın ve santrifüjü açmadan önce aerosollerin yerleşmesi için zaman tanıyın.
— Teneke kutuyu çıkarın ve bir BSC'ye koyun.
— Sorumlu bir süpervizör veya kıdemli kişiyi ve bölgede çalışan diğer meslektaşları bilgilendirin.
— Koruyucu giysi giyerken, BSC'nin altındaki teneke kutuyu açın.
— Tüm yüzeyleri dekontamine etmek için teneke kutuya 1:10 seyreltili çamaşır suyu veya aşındırıcı olmayan bir dezenfektan dökün; teneke kutuyu 20 dakika boyunca ağartıcı veya dezenfektan çözeltisinde bekletin. Teneke kutuyu iyice temizleyin.
— Eldivenli ellerle kırık camları almayın. Forseps veya maşa veya hemostatlarda tutulan forseps veya pamuk kullanın ve bir biyogüvenlik kesici kabına atın.
— Biyolojik tehlike atıklarının bertarafı için teneke kutudan keskin olmayan tüm kirlenmiş malzemeleri kırmızı bir biyolojik tehlike torbasına atın.
— Aynı dezenfektanla kırılmamış kapaklı tüpleri temizleyin veya silin; daha sonra tekrar temizleyin veya silin, suyla yıkayın ve kurulayın.
— Temizleme sırasında kullanılan tüm malzemeler bulaşıcı atık olarak ele alınmalıdır.
Not: Numune tüpü, bireysel teneke kutuları olmayan ancak biyolojik tehlike kapağı ve sızdırmaz rotoru olan bir santrifüjde kırılırsa, temizleme ve dekontaminasyon için üreticinin talimatlarını izleyin.
3.17.3. Otomatik analizörler
- Otomatik analizörler, operatör maruziyetlerini azaltmaya yardımcı olmak için sıklıkla özellikler eklemiştir, ancak bunlar maruz kalma potansiyelini tamamen ortadan kaldırmaz. Daha yeni sistemlerde ortak bir özellik, kapalı sistem örneklemesidir.
- Hızlı hareket eden veya hızlı sıvı veren örnek problar aerosoller ve damlacıklar oluşturabilir.
- Her zaman üreticinin talimatlarına göre aletler kullanın.
- Kullanım sırasında cihaz güvenlik kalkanlarının ve muhafaza cihazlarının yerinde olduğundan emin olun.
- Numune probu ve sıvı seviyesi sensörlerinin yakınındaki el hareketi miktarını sınırlayın.
- Eldiven giyin ve operatörün numune problarını örneklemeden sonra silmesi gereken cihazlarda bir tarafında sızdırmaz plastik kaplamalı gazlı bez kullanın.
- Daha yeni cihazlar, bu maruz kalma kaynağını ortadan kaldıran otomatik prob yıkama döngülerine sahiptir.
- Numune tepsilerini ve numune plakalarını dikkatli bir şekilde tutun ve dökülmeyi önlemek için numune alınmadığında örtün.
- Numune kaplarını ve aliquot tüplerini mekanik cihazlar kullanarak doldurun; asla boşaltın.
- Klinik analizörlerin atıkları kontamine olarak kabul edilecek ve bertaraf eyalet ve yerel düzenlemelere uygun olmalıdır.
- Uygun KKD ve kullanılacak temizleme solüsyonu türü de dahil olmak üzere, bir cihazın üzerinde veya içindeki numune dökülmelerini rutin temizleme ve sorun giderme için üretici talimatlarını izleyin.
- Üretici talimatları dökülme muhafazası ve temizleme talimatlarını içermediğinde, operatörü etkili bir şekilde koruyacak ve cihazın çalışma ömrünü koruyacak ve uzatacak bir SOP geliştirmek için üreticiyle işbirliği yapın.
- Hücre ayıklama makineleri için güvenlik kılavuzları yayınlanmıştır (51). Tam bir kap yaklaşık %10 çamaşır suyu içerecek şekilde atık kabına çamaşır suyu eklemeyi düşünün.
3.17.4. Vakum destekli aspirasyon cihazları (Bkz. Bölüm 3.13.)
3.17.5. Mikrobiyolojide ELISA plaka yıkayıcılar
- ELISA plaka rondelaları, sıvıyı çalkalayarak ve sıvı yüzeyini daha düşük basınç altına yerleştirerek aerosoller ve damlacıklar oluşturabilir. Yıkama ve aspirasyon işlemiyle üretilen büyük parçacıklı damlacıklar, bulaşıcı ajanları yakın yüzeylerde biriktirebilir ve daha ince aerosoller daha uzun mesafeler kat edebilir ve solunabilir.
- ELISA plakalarını her zaman eldivenle tutun ve kontamine olduğunu düşünün.
- ELISA plaka yıkayıcılarını ve çamaşır makinesinin etrafındaki alanı her kullanım günü dezenfekte edin.
- Mümkün olduğunda, laboratuvar çalışanlarının ve çevrenin aerosol kontaminasyonunu en aza indirmek için aerosol muhafaza kapaklarını ELISA plaka rondelalarının üzerine yerleştirin.
3.17.6. Tanımlama, kan kültürü ve PCR cihazları
Bakteriyel tanımlama ve antimikrobiyal duyarlılık aletleri, kan kültürü aletleri, PCR aletleri ve diğer laboratuvar aletleri ve cihazları üreticinin talimatlarına veya tavsiyelerine göre temizlenecek veya dezenfekte edilecektir. Her bir cihaz için rutin ve acil durum temizleme prosedürü, prosedür kılavuzunun güvenlik bileşeninin bir parçası olmalıdır.
3.18. Hızlı Testler (Kitler)
- Hızlı bir test ister laboratuvarda ister bakım noktasında gerçekleştirilsin, kullanılmış test kitleri kontamine olarak kabul edilir ve uygun şekilde atılmalıdır.
- Reaktifleri, numuneleri ve kontrol organizmalarını manipüle ederken aerosol maruziyetlerini önleyebilecek çevresel kontrollerin verimliliğini en üst düzeye çıkarmak için hızlı test kitlerinin kullanımını laboratuvarın belirli bir alanıyla sınırlayın.
- Dökülmeleri içermek ve test kiti malzemelerinin ve kutularının kirlenmesini en aza indirmek için tek kullanımlık, esnek, polietilen film destekli, kaymaz, yüksek emici yüzey astarları önerilir.
- Depolama alanına geri göndermeden önce test kitlerinin dışını uygun laboratuvar dezenfektanı ile silin.
3.19. Tek Yönlü İş Akışı ve Çalışma Alanlarının Ayrılması
- Reaktif hazırlama alanı en temiz alandır, ardından numune hazırlama alanı ve son olarak ürün tespit alanı gelir.
- Belirlenen her alanda taşınabilir eşyalar (ör. kalemler, bant, makas, torpido gözü) bırakın.
- Her alana girmeden önce laboratuvar önlüklerini ve eldivenlerini değiştirin ve ellerinizi yıkayın.
- Bir BSC dışında potansiyel olarak bulaşıcı bir aerosol salınımı meydana gelirse bu acil müdahale prosedürünü izleyin.
— Tüm kişiler, dökülmenin meydana geldiği laboratuvar ünitesini derhal boşaltmalıdır.
— Maruz kalan kişiler tıbbi tavsiye ve değerlendirme için sevk edilecektir.
— Laboratuvar amirini ve biyogüvenlik görevlisini derhal durum hakkında bilgilendirin.
— Aerosollerin taşınmasına ve daha ağır parçacıkların yerleşmesine izin vermek için hiç kimse en az 30 dakika odaya girmemelidir.
— Laboratuvarda merkezi bir hava egzoz sistemi yoksa, giriş daha da ertelenir (örn. 24 saate kadar).
— Girişin yasak olduğunu gösteren işaretler gönderin.
— Uygun süreden sonra, biyogüvenlik görevlisi tarafından denetlenen dekontaminasyona devam edin. Solunum cihazlarını içerebilen uygun KKD giyilmelidir.
4. Tüberküloz Laboratuvarı
Enfeksiyöz aerosollere maruz kalmaktan kaynaklanan tüberküloz (TB) laboratuvarlar için büyük bir risk olmaya devam etmektedir. 1-10 kadar az organizmaya maruz kalma hastalığa neden olabileceğinden güvenli bir maruz kalma seviyesi yoktur. Laboratuvarcıların tahmini %8-30'u tüberkülin dönüşümleri yaşayabilir (52). Mycobacterium tuberculosis'e maruziyetleri azaltmak için, güvenli çalışma uygulamaları, muhafaza ekipmanı kullanımı ve özel olarak tasarlanmış laboratuvar tesisleri dahil olmak üzere bir kontrol hiyerarşisi kullanılmalıdır (1). Tüberküloz laboratuvarlarının ana mikrobiyoloji laboratuvarından ayrı ve izole olması gerekir. Laboratuvarın biyogüvenlik kılavuzunda belgelenen bir risk değerlendirme süreci kullanarak güvenlikle ilgili tüm politikaları ve uygulamaları geliştirin.
- Her yeni çalışanın uygun ve güvenli taşıma uygulamalarını, biyolojik güvenlik kabini (BSC), kişisel koruyucu ekipman (PPE) gibi güvenlik ekipmanlarının kullanımını, dekontaminasyon prosedürlerini, dökülme temizliği, otoklav kullanımı, atık bertarafı, tüberküloz hastalığı semptomları bilgisi ve hastalık ve maruziyetleri bildirmeyi içeren güvenlik eğitimi almasını sağlamak laboratuvar direktörünün sorumluluğundadır.
- En önemlisi, biyogüvenlik uygulamalarına bağlılık izlenmeli ve yıllık bir yetkinlik değerlendirmesi tamamlanmalıdır.
- Çalışanlar ve laboratuvar yönetimi, TB laboratuvarının saatte kaç hava değişimi gerçekleştiği, negatif basıncın nasıl ölçüldüğü, kapıların otomatik olarak kilitlenip kilitlenmediği ve interkomun pakette nasıl çalıştığı gibi mühendislik bileşenlerine aşina olmalıdır.
4.1. Numune Alma ve Oturum Açma/Kurulum İstasyonu
Çoğu klinik laboratuvarda numuneler ilk olarak ana mikrobiyoloji laboratuvarında (biyogüvenlik seviyesi [BSL]-2) alınır ve burada diğer bakteriyolojik testler için oturum açılır ve işlenir. TB analizi için gönderilen numuneler, TB'ye özgü daha ileri işlem için TB laboratuvarına taşınır.
4.1.1. Ana mikrobiyoloji laboratuvarında numune alımı
- Tüberküloz testi için balgam, idrar, doku, beyin omurilik sıvısı ve mide yıkamaları dahil olmak üzere çok çeşitli örnekler alınır.
- Aerosol üretmeyen klinik örnekler üzerindeki prosedürler bir BSL-2 laboratuvarında gerçekleştirilebilir. BSL-3 laboratuvarında propogasyon ve kültür manipülasyonu yapılmaktadır.
- Özellikle TB testi için sunulan tüm klinik örnekler, laboratuvar önlüğü ve eldivenlerden oluşan KKD kullanan kişiler tarafından ele alınmalı ve çalışma en az yıllık olarak onaylanmış bir BSC (53) üzerinde yürütülmelidir.
- Herhangi bir TB numune kabını açmadan önce, görünür kontaminasyon varlığından bağımsız olarak, tüberkülosidal dezenfektana batırılmış gazlı bezle silerek dışını dezenfekte edin.
- Örnekleri, TB numune dekontaminasyonu, kültür yayımı ve ardından kültürlerin manipülasyonu için tüm prosedürlerin BSL-3 tesislerinde ve muhafaza ekipmanı ve uygulamaları ve solunum koruması kullanılarak gerçekleştirildiği tüberküloz laboratuvarına taşıyın (1). BSL-3 tesisinin bakımı uygun şekilde yapılmalı ve laboratuvara açılan kapı kapalı tutulmalıdır.
- Bir BSL-3 laboratuvarını barındıracak şekilde bir BSL-2 tesisinin güçlendirilmesi, M. tuberculosis için test edilmesi gereken bazı tesisler için bir seçenek değildir. Mikrobiyolojik ve Biyomedikal Laboratuvarlarda Biyogüvenlik (BMBL-5) (1), bir BSC kullanılmışsa ve hava binanın dışına kadar tükenmişse, BSL-3 prosedürlerinin M. tuberculosis ile çalışırken bir BSL-2 laboratuvarında yapılabileceğini düşündüren dili ortadan kaldırmıştır. Bu alternatifin, yalnızca üç koşul belgelenebiliyorsa, BSL-3 tesisi olmayan laboratuvarlar için kullanılması önerilir: 1) bir risk değerlendirmesi, M. tuberculosis ile çalışmanın BSL-3 uygulamaları ve prosedürleri kullanılarak ayrı, kapalı bir BSL-2 laboratuvarında güvenli bir şekilde yürütülebileceğini belirler; 2) laboratuvar odasından egzoz havası binanın dışına havalanır; ve 3) laboratuvar müdürü uygulamayı onaylar. Bu koşullardan herhangi biri karşılanamazsa, kültür manipülasyonu için bir BSL-3 tesisi önerilmektedir.
4.1.2. Diğer laboratuvar bölümlerinde numune alımı
- Cerrahi bir patoloji süitinde tüberküloz şüphesi olan örnekleri işlerken, donmuş kesit sırasında bir N95 partikül solunum cihazı takın. Dokuyu dondurmak için itici kullanmayın.
- Otopsi prosedürlerini gerçekleştirirken, kemik tozunun dağılmasını en aza indirmek için kemik testerelerinde bir vakum ataşmanı olmalıdır. Tüberkülozdan şüpheleniliyorsa, işlem sırasında bir N95 partikül solunum cihazı veya güçlü hava temizleyici solunum cihazı (PAPR) takın ve laboratuvar biyogüvenlik kılavuzunda belirtildiği gibi, havadaki partiküllerin havalandırma sistemi tarafından etkili bir şekilde çıkarılması için prosedürden sonra yeterli süre geçene kadar çıkarmayın.
4.1.3. Sızıntılı kaplar
- Sızdırmaz bir kapta işlenmek üzere numuneleri toplayın ve numuneleri sızdırmaz bir plastik torba içinde laboratuvara taşıyın. Uygun bir kap, numunenin taşınmasının dış kontaminasyon olmadan başlayabilmesini sağlar.
- Taşıma çantası, aerosollerin, spreylerin ve sıçramaların oluşumuna karşı korumak için bir BSC'nin içinde açılır.
4.1.4. Kabın dışında gözle görülür kontaminasyon
- Taşıma sırasında sızan numuneler reddedilmeli ve yeni bir numune talep edilmelidir. Bir taşıma çantasını açmadan önce, numunede sızıntı olup olmadığını gözlemleyin.
- Kabın dışı kabın içeriğiyle büyük ölçüde kirlenmişse, numuneyi reddedin, reddi belgeleyin ve başka bir numune talep edin.
- Numune kabının dış kısmının incelenmesi küçük veya yüzeysel kontaminasyon gösterdiğinde, daha fazla işlemden önce dış kısmı uygun bir dezenfektanla temizleyin.
- Bir numune kabını dikkatlice açın çünkü sıçrama veya sıçrama kabın dışını kirletebilir.
- Kapakları çıkarıp değiştirdikten sonra kabın dışını tüberkülosidal bir dezenfektana batırılmış gazlı bezle silin.
4.2. Lekeler ve Bertararaf
Bir BSC'de smear hazırlayın çünkü aerosoller, damlacıklar ve sıçramalar üretilebilir. Lekelenmemiş lekeler canlı tüberkül basil içerebilir ve dikkatli bir şekilde ele alınmalıdır.
4.2.1. Gram lekesi
Rutin kültürler, özellikle balgam ve diğer solunum örnekleri için gönderilen örnekler, tüberkül basilleri içerebilir ve asitli basil (AFB) kültürlerinin sipariş edilip edilmediğine bakılmaksızın dikkatli kullanılmalıdır.
4.2.2. Asit hızlı lekeler — Kinyoun, Ziehl-Neelsen, auromine–rhodomine (floresan)
- BSC'den smearları çıkarmadan önce, sürgüyü bir elektrikli sürgülü ısıtıcıya, sıcaklık 149° ve 167°F (65° ve 75°C) arasında ayarlanmış şekilde 2 saat boyunca sabitleyin. Her kullanım günü slayt ısıtıcısının sıcaklığını izleyin ve kaydedin. Isıya sabitlemeden sonra bile, slayt canlı tüberkül basil içerebilir ve kontamine olarak tedavi edilmelidir.
— AFB kültürlerini işlemeyen ancak doğrudan smear yapmak isteyen laboratuvarlar için smear BSL-2 laboratuvarında yapılabilir.
— Slaytların sabitlenmesi için alev yerine sürgülü ısınma tepsisi kullanılması önerilir. Asitli boyama için sıvılaştırılması ve sputa konsantrasyonu, önce numuneyi bir BSC'de eşit hacimde %5 sodyum hipoklorit çözeltisi (seyreltilmiş ev tipi ağartıcı) ile işleyerek ve işlemden önce 15 dakika bekleyerek açık tezgahta güvenle gerçekleştirilebilir (1).
4.3. Açık Bankta Kültür Okuma ve Kabul Edilebilir Etkinlikler
- Sadece sadece gözlemsel olan ve aerosol oluşturma riski olmayan faaliyetler açık tezgahta gerçekleştirilebilir. Büyüme kolonilerinin herhangi bir manipülasyonu BSC (54) içinde gerçekleştirilir. Sadece kapalı, cam olmayan kültür kapları, kabın dışı uygun şekilde dezenfekte edilmiş, spektrofotometre veya diğer gözlemsel okumalar için BSC'den çıkarılabilir. Ancak tercih, kültürlerle ilgili tüm çalışmaların sertifikalı bir BSC içinde yürütülmesidir.
- Kültür kırılması olasılığını ele almak için prosedürler mevcut olmalıdır (Bkz. Bölüm 4.7, Dökülme Temizleme). Canlı kültürler, kırılmayı önlemek için raflar, güvenlik taşıyıcıları ve/veya arabalar kullanılarak güvenli bir şekilde taşınmalıdır.
- Laboratuvarda test yapılan her gün çalışma yüzeyleri dekontamine edilmelidir.
4.4. Kişisel Önlemler ve İş Uygulamaları
Önlemler ve çalışma uygulamaları, gerçekleştirilmekte olan prosedürde karşılaşılan tüberkül basillerinin potansiyel miktarı ile ilgili olarak seçilir. Bu nedenle, örnekler, organizma sayısının arttığı bir kültürden daha düşük bir konsantrasyona sahiptir. Numuneye enerji verildiğinde aerosoller üretildiğinden, TB laboratuvarındaki tüm protokoller, aerosol üretme potansiyeli için risk değerlendirme süreci aracılığıyla değerlendirilir. Yaygın aerosol üreten prosedürler, sıvı kültürleri ve süperfant sıvıları dökmek, sabit hacimli otomatik pipetterler kullanmak ve sıvı kültürlerini bir pipetle karıştırmaktır.
- M. tuberculosis'in patojen olduğundan şüphelenilen örnekleri işleyen ve/veya M. tuberculosis için tanısal test yapan laboratuvarlar, tüberküloz enfeksiyonu için en az yıllık teste tabi tutulmalıdır. Bu, bir tüberkülin cilt testi (TST) veya interferon gama salınım testi (IGRA) ile gerçekleştirilebilir. TST yapılırsa, işe alım sırasında iki aşamalı bir süreç kullanılır ve daha sonra tek adımlı bir TST izler. Tüberküloza maruz kalma veya belgelenmiş bir dönüşüm riski olan bir laboratuvar olayı meydana gelirse, TB için daha sık tarama gerekli olabilir. Laboratuvarcının BCG aşısı veya daha önce pozitif TST öyküsü varsa, bir TST yerleştirmeyin, bu durumda bir IGRA yapılır.
- Personel, sağlıktaki bazı değişikliklerin, örneğin kemoterapi almanın, maruz kalma meydana gelirse onları tüberküloz riski altına sokabileceğinin farkında olmalıdır.
4.4.1. Kişisel koruyucu ekipman
- Spreylere ve sıçramalara karşı koruma olarak rutin olarak rahat (örgü) manşetli solid-front, tek kullanımlık bir elbise kullanılır.
- BSL-3 tesisinde çalışırken eldivenler her zaman giyilmelidir ve elbisenin kollarıyla dışarıdan örtüşecek kadar uzun olmalıdır. BSL-2 ortamında, eldiven giymek, bir risk değerlendirmesi tarafından yönlendirilen laboratuvarın rutin uygulamasına bağlıdır.
— Genel olarak, aerosol üreten prosedürler sırasında sprey, sıçrama veya damlacıklardan kaynaklanan cildin kirlenmesi için makul bir risk olduğunda eldivenler giyilir. Eldivenler, dış kontaminasyon için kabın dışını gözlemlemenin ilk işinden başlayarak kullanılır.
— BSL-3 ortamı dışındaki kültürleri gözlemlerken eldiven gerekli değildir. - Rutin iş uygulaması olarak, laboratuvardan çıkarken tüm dış koruyucu giysileri çıkarmalıdır. Eldiven giyilip giyilmediğine bakılmaksızın, prosedürlerin tamamlanmasından sonra ellerin iyice yıkanması gerekir.
4.4.2. Solunum koruması
- Numuneleri veya TB kültürlerini işlerken ve manipüle ederken laboratuvarı korumak için N95 gibi bir solunum cihazı takılması şiddetle tavsiye edilir. Cerrahi maskeler daha az etkilidir çünkü aerosollerden korumak için değil, kullanıcı tarafından dışarı atılan aerosolleri içerecek şekilde tasarlanmıştır. Personel, N95 solunum cihazı kullanmadan önce tıbbi olarak değerlendirilmeli ve uygun test edilmelidir. Bir kişi bir N95 solunum cihazı (örneğin, sakallı bir kişi) için başarılı bir şekilde uygun test edilemezse, kabul edilebilir bir alternatif PAPR'dir.
- Hiçbir BSC %100 etkili değildir. Arızalar meydana gelir ve solunum cihazları ek koruma sağlar.
- Tüberküloz laboratuvarında çalışan personel, OSHA gerekliliklerini karşılayan tesisin solunum koruma programına uymalıdır (55).
— Solunum koruma programının bileşenleri yazılı standart işletim prosedürü, eğitim, yeniden kullanılacaksa solunum cihazının depolanması, kullanımdan önce solunum cihazının muayenesi, tıbbi inceleme ve program değerlendirmesidir.
— Solunum cihazı programına katılmaya uygunluk, tıbbi bir inceleme ve bir pulmoner fonksiyon testi içerir.
— Kullanmadan önce, işçiye en uygun solunum cihazının boyutunu belirlemek ve yüze sıkı bir sızdırmazlık sağlamak için solunum cihazına uyum testi yapılmalıdır.
— Yıllık uyum testi, personelin solunum cihazının uygun şekilde takıldığını göstermesi için bir fırsattır. - Laboratuvar personeli için KKD gereklilikleri dış servis teknisyenleri tarafından da takip edilmelidir. Yeterli güvenlik önlemlerine uyulmasını sağlamak için eğitimli bir teknik veya profesyonel kişi mevcut olmadığı sürece, bir BSL-3 tesisinde servis, temizlik veya ekipman kontrolüne izin vermeyin.
- BSL-3'te giyilen KKD, laboratuvardan çıkmadan önce çıkarılmalıdır. KKD çıkarıldıktan sonra eller her zaman iyice yıkanır. Aynı şekilde BSL-2'de giyilen KKD'ler de laboratuvardan çıkmadan önce çıkarılmalıdır. Laboratuvarda çalışırken kullanılan laboratuvar önlükleri laboratuvar dışında asla giyilmez.
4.5. Dezenfeksiyon
- Tüberkülosidal aktivitesine göre tüberkülosidal laboratuvarı için bir dezenfektan seçilir ve orta aktivite seviyesi (1) olarak kategorize edilir. Yaygın olarak seçilen bileşikler fenolikler, iyodoforlar, klor bileşikleri veya alkollerdir. Mikrop öldürücülerin öldürme süresi asla anlık değildir ve uygun bir dezenfektan seçerken kirlenmiş malzemenin maruz kalma süreleri ve matrisi dikkate alınmalıdır.
- M. tuberculosis kurumaya karşı çok dirençli olduğundan ve katı yüzeylerde uzun süre hayatta kalabildiğinden TB laboratuvarında tüm yüzeylerin günlük dezenfeksiyonu gereklidir.
- İyi bir dezenfeksiyon uygulaması, bir gazlı bez veya kağıt havluyu dezenfektana batırmak ve numuneleri işlerken BSC'nin içindeki çalışma yüzeyine yerleştirmektir.
- BSC'de sıvıları boşaltırken, sıçramaz bir kap kullanın. Dezenfektan, kullanımdan önce su sıçramasına dayanıklı bir kaba eklenmelidir. Su sıçramasına dayanıklı kabın bir hunisi varsa, kullandıktan sonra dezenfektanla durulayın.
- Tel halkalardan veya maçalardan büyük organizma kümelerini çıkarmak için bir döngü yakma cihazı veya bir alkol kum şişesi kullanın.
4.6. Laboratuvar Atıklarının Dekontaminasyonu ve Bertarafı
- Üretilen atıkların laboratuvardan taşınmadan önce sterilize edilebilmesi için mikobakteriyoloji laboratuvarında bir otoklav sağlayın. Otoklav için planlanan kalite kontrol ve bakım prosedürlerine uyun.
- Bir otoklav mevcut değilse veya otoklavlanamayan maddeler için, mikobakteriyoloji laboratuvarından gelen tüm atıklar sızdırmaz kaplarda güvenli bir şekilde bulunmalıdır. Atıkları, kabın dışı laboratuvardan çıkmadan önce dezenfekte edilecek şekilde paketleyin.
- Atık malzemeleri BSC'den çıkarmadan önce kimyasal olarak dezenfekte edin.
4.7. Düzülme Temizliği
- Bir dökülme durumunda yanıt, üretilen aerosollerin miktarına bağlıdır. Minimum bir aerosol veya majör aerosol dökülmesi müdahale prosedürünü izleme kararı, süpervizör ve güvenlik görevlisi ile birlikte ve biyogüvenlik kılavuzuna uygun olarak verilir (Tablo 6).
— Dökülen bir numuneden olduğu gibi minimal aerosoller üretilirse, dökülmeyi emici kağıt havlularla örtün ve tüberkülosidal dezenfektanla doldurun.Güvenlik görevlisi tarafından belirlenen şekilde, havadaki parçacıkların en az %99'u çıkarılana kadar laboratuvarı bırakın (Tablo 6). Dezenfektanın yeniden girene kadar dökülme üzerinde durmasına izin verin. Zeminleri ve tezgahı dezenfekte edin.
— M. tuberculosis içeren bir sıvı kültür gibi büyük bir aerosol üreten dökülme veya kırılma durumunda, laboratuvarı derhal tahliye edin. Tablo 6'daki kılavuz kullanılarak güvenlik görevlisi tarafından belirlenen damlacık çekirdeklerinin %99-%99,9'unu çevreden çıkarmak için yeterli hava değişimi gerçekleşene kadar hiç kimse bölgeye yeniden giremez. Süpervizör veya güvenlik görevlisi, laboratuvarı formaldehit gazı veya başka bir ajanla dekontamine etmenin gerekli olduğunu belirleyebilir. Dökülmeleri veya kırık malzemeleri temizlemek için uygun solunum cihazı koruması ve diğer KKD giyilmelidir. Kırık camı ellerinizle almayın.
4.8. Laboratuvarın Temiz ve Kirli Alanları
- Laboratuvar çalışma alanı düzenli kalmalı ve malzeme akışı temiz bir alandan laboratuvarın kirli bir alanına olacak şekilde düzenlenmelidir.
- BSC'nin içinde, numunenin, pipetlerin, ilmeklerin, tüplerin, slaytların veya diğer aletlerin manipülasyonundan kaynaklanabilecek herhangi bir damla veya sıçramayı yakalamak için yakın çalışma alanı tüberkülosidal dezenfektanla ıslatılmış bir ped ile kaplanacaktır. İş işlemleri sırasında gazlı bez pedi kurursa, tekrar ıslatın.
4.9. AFB Kan Kültürleri
- Mikobakteri analizi için gönderilen kanı rutin kan kültürleri ile işlemeyin. Tercih edilen örnek tam kandır. Bir BSL-3 laboratuvarında işleyin.
- Mikobakteriler için rutin bir kan kültürünün işlenmesi gerekiyorsa, tüm çalışmaları bir BSL-3 tesisinde pozitif bir kan kültürü üzerinde yürütün.
4.10. Enstrümantasyon
- Canlı tüberkül basili içerebilecek bir numunenin santrifüjlenmesi için güvenlik-kalkanı rotorlu aerosol-proof santrifüj gereklidir.
- Numune tüplerini dekontamine edin ve santrifüje taşınmadan önce BSC'nin içindeki kubbeli O-ring-sızdırmaz güvenlik kaplarına yerleştirin veya dekontamine edilmiş tüpleri bir rafa yerleştirin ve santrifüje taşıyın. Santrifüjlemeden sonra, açılmamış tüpleri BSC'nin içine girene kadar taşıyıcıda tutun; daha sonra su sıçramasına dayanıklı bir kaba boşaltın.
- Otomatik bir hareket algılama musluğu veya diz veya ayak kontrolleri ile donatılmış bir lavabo takın.
4.11. Test
4.11.1. Hızlı test (doğrudan moleküler test kitleri)
- Tüm çalışmaları bir BSL-3 laboratuvarında ve BSC içinde gerçekleştirin.
- Hızlı bir testin yapılacağı numune inaktive edildikten veya genetik materyal çıkarıldıktan sonra, BSL-2 laboratuvar ortamında daha fazla test yapılabilir.
4.11.2. Moleküler test
- Tüberkül basili ve mikobakteriyel kültürlerin manipülasyonundan şüphelenilen numunelerin işlenmesini içeren tüm çalışmalar bir BSL-3 laboratuvarında ve BSC içinde yapılmalıdır.
- Moleküler testin yapılacağı numune inaktive edildikten veya genetik materyal çıkarıldıktan sonra, BSL-2 laboratuvar ortamında daha fazla test yapılabilir.
5. Otopsi/Nekropsi, Cerrahi Patoloji
- Otopsi (insan kadavra muayenesi). Otopsi yapan laboratuvar çalışanı için bulaşıcı ve tehlikeli riskler, kullanılan prosedürler, değerlendirilen nüfus ve açık bir alanda iş performansı nedeniyle diğer sağlık profesyonellerine göre daha yüksektir. Neşter, testere ve iğnelerin yanı sıra vücuttaki keskin nesnelere, kemik parçalarına, kırık metale ve/veya iğnelere maruz kalmanın yanı sıra kesiklere ve perkütan yaralanmalara neden olabilir. Vücut sıvısı ve kan sıçramalarına neden olan büyük organların manipülasyonu ve hortum ve testere gibi enstrümantasyonların kullanılması, ortamdaki soluma, doğrudan temas veya kontamine maddelerle temasa neden olabilecek açık bir alanda aerosoller oluşturur. Otopsiye doğrudan katılanlar ve odadaki diğer kişiler maruz kalma riski altındadır. Diğer potansiyel güvenlik riskleri arasında formalin, terapötik radyasyon boncukları ve tutulan elektrik donanımı gibi kimyasallara maruz kalma yer alır. Uyanık ve iyi eğitimli bir işçi, iyi tesis tasarımı, optimum şekilde uygun ve kullanıcı dostu kişisel koruyucu ekipman (PPE), vücudun ve disseke materyalin manipülasyonu sırasında uygun cerrahi prosedürler ve müteakip dezenfeksiyon ve sterilizasyon prosedürlerinin tümü, otopsi ve mumyalama sırasında biyogüvenlik riskini en aza indirmede kritik öneme sahiptir.
- Nekropsi (hayvan kadavra muayenesi). Laboratuvardan edinilen enfeksiyon riski, insan kadavraları (esasen tüm kadavralardaki bulaşıcı ajanlar insanlar için bulaşıcıdır) ile çalışırken hayvan kadavralarına (çoğu kadavralardaki bulaşıcı ajanların insan patojenleri olmadığı) karşı çok farklıdır. Ne olursa olsun, hayvan kadavraları zoonotik ajanları barındırabilir ve Bölüm 12'de özetlendiği gibi bir kadavrada zoonotik enfeksiyöz ajanların mevcut olup olmadığını belirlemek için risk değerlendirmesi, uygun hayvan nekropsi biyogüvenlik prosedürlerinin oluşturulmasında kritik derecede önemlidir. Bu bölümdeki kılavuzlar, hem insan otopsisi hem de insan cerrahi patolojisi ve hayvan nekropsisi ve veteriner cerrahi patolojisi için kombine biyogüvenlik en iyi uygulamalarıdır. Gerektiğinde, insan veya hayvan tanı laboratuvarı ayarlarına özel biyogüvenlik kılavuzları vurgulanır.
5.1. Otopsi/Otopsi-İlişkili Enfeksiyonlar
Otopsi/nekropsi sırasında meydana gelen laboratuvar kaynaklı enfeksiyonların ve tehlikeli maruziyetlerin çoğunun kaynağı bilinmemektedir ve tüm otopsiler ve nekropsiler riskli olarak kabul edilecektir (1,56).
- İnsan otopsi tesisleri, doğrudan otopsi ile ilgili olanların ve çevredeki personelin (1,56-58) optimum şekilde korunması için biyogüvenlik seviyesi 3'te (BSL-3) en güvenli şekilde çalışacaktır. Bir BSL-3 tesisi mevcut değilse, otopsiler BSL-2'nin bariyer önlemleri artı BSL-3'ün negatif hava akışı ve solunum önlemleri kullanılarak yapılabilir (56).
- Hayvan nekropsi tesisleri, bir case-by-case-risk değerlendirmesi tarafından garanti edildiğinde BSL-3 uygulamaları için bir seçenekle BSL-2'de çalışabilir (örneğin, Sınıf II biyolojik güvenlik kabininin (BSC), aşağı akım nekropsi tablolarının ve göz ve yüz koruması gibi uygun KKD'nin mevcudiyeti göz önünde bulundurulduğunda). Sadece bir risk değerlendirmesi, yüksek sonuçlu bir hayvancılık patojeninin (USDA hayvancılık seçme ajanı veya toksin [Bkz. Bölüm 12.1]) varlığı için yüksek bir olasılığa işaret ederse, BSL-3 tesisleri gerekli olacaktır.
- Tıbbi Direktör veya hayvan nekropsisi durumunda, ilgili patolog, risk değerlendirmesinden ve sınırlı otopsi/nekropsi prosedürlerinin ve ardından her otopsi/nekropsiden önce personel için kabul edilebilir risk seviyesinin değerlendirilmesinden sorumludur (1,2,56,59)
- Güvenlik prosedürleri konusunda eğitim alacak bir personel seçin ve bu kişiye patoloji paketinde güvenlik prosedürleri ve risk analizi gözetimi verin.
5.1.1. Kan yoluyla bulaşan patojenler
Otopsilerin gerçekleştirilmesinde yer alan insan sağlığı çalışanları, hem devam eden yaralanmalar hem de otopsi yapılan nüfus nedeniyle mesleki olarak edinilmiş kanla bulaşan patojenler için yüksek risk altındadır. Bulaşma riski, sırasıyla hepatit B virüsü, ardından hepatit C virüsü ve insan immün yetmezlik virüsü için maruz kalma başına en yüksektir. Bu enfeksiyonlar otopsilerden ve mumyalama sırasında belgelenmiştir (1,2,56,60–62).
5.1.2. Diğer enfeksiyonlar
Sitomegalovirüs gibi diğer kan yoluyla bulaşan patojenler için spesifik veriler eksiktir, ancak bulaşıcı bulaşma mümkündür ve risk özellikle hamile (serolojik olarak negatif) veya bağışıklık sistemi baskılanmış çalışanlar için daha yüksek olabilir. Enfeksiyon riski daha yüksek olan kişileri case-by-case bazında değerlendirin ve otopsiye katılmaya ancak danışmanlıktan sonra rıza göstermelerine izin verin (2,63).
5.1.3. Enfeksiyöz aerosoller
Zoonotik ajanlardan şüphelenilen kadavraların otopsileri/nekropsileri potansiyel olarak bulaşıcı aerosoller üretir. Mycobacterium tuberculosis, aerosolizasyon yoluyla en çok bulaşan prototip patojen olmasına rağmen, meningokokemi, şarbon, rickettsiosis ve lejyonelloz olan kişiler diğer örneklerdir. Enfeksiyöz dokunun manipülasyonu, her iki havadaki partikülün de uzun süre hava akımları üzerinde yüzen ve daha sonra daha hızlı yerleşen pulmoner alveollere ve küçük damlacık parçacıklarına (>5 µm) ulaşabilen bir boyutta (<5 µm) ile sonuçlanabilir. Sıvı emişe hortumlarından, kadavranın püskürtülmesinden ve salınan testerelerden kirlenme meydana gelebilir. Oluşturulan aerosoller otopsi alanında kalır ve daha sonra ağız ve gözlerle temas, inhalasyon veya yutma ile sonuçlanabilir ve bilgisayarlar, telefonlar ve kamera ekipmanı gibi cansız yüzeyleri kirletebilir (56,57).
5.1.4. Ek güvenlik uygulamaları gerektiren organizmalar
- Otopsi kaynaklı Creutzfeldt-Jakob hastalığı (CJD) vakası belgelenmemiştir. Ancak, prion enfeksiyöz partikülü normal dekontaminasyon ve sterilizasyon yöntemleriyle bulaşıcı hale getirilemeyeceğinden, gelişmiş önlemler zorunludur. Prionun bulaşabilirliği formalin-sabitlenmiş parafin bloklarında (64-67) korunur.
- Bilinen zoonotik enfeksiyon potansiyeline sahip tek doğal hayvan prion hastalığı klasik sığır süngerimsi ensefalopatidir (BSE). BSE şüphesi olan sığırlar için nekropsi kılavuzları başka bir yerde yayınlanmaktadır ve öncelikle deri delinmesinden kaçınmaya, mukoza zarlarına sıçramaları azaltmaya, tesisleri ve ekipmanları dekontamine etmeye ve karkasların atılmasına odaklanır (68).
5.1.5. Diğer biyogüvenlik maruziyetleri
- Siyanür, metalik fosfitler ve organofosfat pestisitler
— Özel önlemler gereklidir ve dışarıya kanalili bir davlumbaz veya sınıf II tip B2 BSC kullanımı, duman solunum cihazları, otopsi/nekropsi sınırlama ve maruz kalma süresi sınırlama (56). - Tanısal radyoaktif boncuklar veya terapötik taramalar
— Radyasyona maruz kalmayı sınırlamak, vücudu transfer etmek ve personelin maruz kalma sonrası testleri için önerilen uygun önlemler için kayıtlı radyasyon güvenliği görevlisine danışın. - Elektrik ve diğer donanım tehlikeleri (kalp pili, ikamet kateterleri)
— Otopsi devam etmeden önce kalp pillerini devre dışı bırakın. Defibrilatörler mevcut olduğunda elektrik akımının boşaltılması mümkündür. Donanım varsa, otopsi sırasında kesme yaralanmalarına neden olmayacak şekilde not edilmeli ve daha sonra çıkarılmalıdır.
5.1.6. Mortisyeye rapor vermek
Bilinen kanla bulaşan patojenleri veya diğer şüpheli aerosolizasyon tehlikesini, taşıma veya mumyalama sırasında oluşabilecek sonraki bulaşımları sınırlamak için zortisyene ve potansiyel olarak vücudu tutan diğerlerine bildirin (69).
5.1.7. Hayvanların Nekropsi kalıntıları
Potansiyel zoonotik enfeksiyöz ajanlar içeren hayvan kadavralarını uygun dekontaminasyon (örn. yakma, alkali sindirim veya diğer yöntemler) ile atın ve özel gömülme için hayvan sahiplerine iade etmeyin.
5.2. Otopsi/Nekropsi Süiti
5.2.1. Vücudu/karkası inceleyin
- Ölümden sonra tutulan implante edilmiş eşyaları arayın. Bunlar, vücuttan sızan vücut sıvılarını azaltmak için taşımadan önce not edilmeli ve kelepçelenmeli veya kapatılmalıdır. Vücutta görünür kanlı/vücut sıvılarından temizleyin. Sıvıların çoğunu tutmak için otopsi masasını plastik bir tabaka ile örtün veya alternatif olarak, sıvıların kovalarda veya yer giderlerinde toplanabilmesi için drenajlı masalar kullanın.
- Şüpheli bulaşıcı ajana (örneğin, yakma, kompostlama) bağlı olarak yeterli dekontaminasyon sağlayan yöntemler kullanarak, şüpheli zoonotik ajanlarla hayvanların nekropsisinden sıvıları ve dokuları uygun şekilde atın.
5.2.2. Süit için güvenlik yönergeleri
- Otopsi paketini girişte biyolojik tehlike alanı olarak işaretlemek için evrensel biyolojik tehlike sembolünü kullanın.
- Otopsi paketine güvenli erişim sağlayın ve yalnızca bu alana özgü biyogüvenlik prosedürleri konusunda eğitimli personele erişim izni verin.
- Vakum hortumlarını sıvı dezenfektan tuzakları ve HEPA filtreler veya eşdeğerleri ile koruyun.
- Aerosolleri azaltmak için mümkün olduğunda el testereleri kullanın. Kesmeden önce kemiği nemlendirin. Patolog, vakum tutturmalı salınan kemik testerelerini kullanmayı seçebilir; bunları mümkünse kapalı bir alanda kullanın. Bu vakum ataşmanlarının temiz tutulması zordur ve potansiyel bir enfeksiyon riski olarak ele alınmalıdır. Açıkta kalan kemiğin sonraki pürüzlü kenarlarını havlularla örtün. Prionlardan şüphelenildiğinde otopsi sırasında kafatasını keserken, kafayı torbalayın.
- Kullanılmış iğneleri masanın üzerinde bırakmayın. İğneleri çıkarmayın veya yeniden ısıtmayın. Tüm üniteyi keskin bir kaplara atın. Keskin uçlu kapların çalışma alanında mevcut olduğundan emin olun ve hiçbir zaman üçte ikiden fazla dolu olmadıklarından emin olmak için bunları periyodik olarak inceleyin. Bu seviyeye ulaştıklarında kapatın ve değiştirin.
- Herhangi bir zamanda insan vücudu üzerinde çalışan personel sayısını prosektör ve/veya hekim ve sirkülatör ile sınırlayın. Belirli bir zamanda yalnızca bir kişinin kesmesine izin verin. Aynı sayı sınırlaması küçük hayvan otopsisi için de geçerli olmalıdır. Büyük hayvan nekropsisi genellikle birden fazla prosektörün kazara yırtılmaları önleyecek şekilde birlikte çalışmasını gerektirir.
- Otopsiden önce birden fazla neşter hazırlayın, böylece eller kaygan ve kontamineyken bıçak değişimi önlenebilir. Alternatif olarak, bıçakları değiştirmeden önce dış eldivenleri değiştirin. Mümkün olduğunda neşter yerine künt uçlu makas kullanın ve kayganlaşırlarsa masadan enstrümanlar seçmek için bir mıknatıs kullanın.
- Başka bir kişiye neşter veya makas gibi keskin nesneleri geçirmeyin. Başka bir kişinin alması için onları masaya yerleştirin.
- Numune kaplarını (örn. kan kültürü şişeleri) aşılama için temiz bir yüzeye yerleştirin. Mümkünse bir raf kullanın. Aşılama yaparken ellerinizde tutmayın.
- Vücuttaki organların incelenmesi ve iç içi boşaltma tekniği kana, vücut sıvılarına ve kesiklere maruz kalmayı sınırlayacak şekilde düşünülmelidir.
- Otopsi tablosundan çıkarılacak sabitlenmemiş doku için aşağıdakileri yapın.
— Sıvıların sıçramasını veya damlamasını önlemek için bir tepsiye veya bir kovaya yerleştirin.
— Muayene, kesme ve/veya fotoğraftan sonra, dokuyu vücutta değiştirilmek ve/veya sabitlenmek üzere otopsi tablosuna geri gönderin.
— Kültür veya diğer laboratuvar testleri için sunulacak örnekleri, dış yüzeyde dekontamine edilmiş ve daha sonra ikincil bir sızdırmaz kaba yerleştirilen ve biyolojik tehlike olarak etiketlenen birincil bir kaba koyun.
— Büyük organların çıkarılması ve birden fazla bölüme (ekmek) kesilmesi gerekecektir, böylece fiksasyon için dokunun yeterli nüfuzu meydana gelecektir.
— Vücuda geri gönderilmeyecek sabitlenmemiş doku biyolojik tehlike atığı olarak kabul edilir ve minimumda tutulmalı ve daha sonra uygun dekontaminasyona izin verecek şekilde atılmalıdır.
— Otopsi için, sütür veya zımba kapalı vücut. Dikiş yaparken cilt kapaklarını ellerle değil forsepsle tutun.
— Sabitlenmemiş herhangi bir dokunun gözden geçirilmesi, otopside kullanılanla aynı KKD'nin kullanılmasını gerektirir. - Dikte sırasında eller serbest veya ayakla etkinleştirilen kayıt cihazları ve cansız yüzeylerin kirlenmesini en aza indirmek için bir hands-free hoparlör kullanın.
- Çıkışta yıkama için eller serbest bir lavabo sağlayın.
- Bir göz yıkama istasyonu ve duş sağlayın (2).
5.3. Kimyasallar (Formaldehit)
Numunenin korunması için kullanılan Formaldehit (%3,7–4,0) otopsi çalışanlarının maruz kaldığı en yaygın toksik kimyasaldır. Kimyasal uçucu ve toksiktir ve gözlerde, mukoza zarlarında ve ciltte tahrişe neden olur ve tüm kanserler için artan risk ile ilişkilidir. İş Güvenliği ve Sağlığı İdaresi (OSHA) düzenlemeleri, 8 saatlik zaman ağırlıklı ortalama olarak 0,75 ppm ve kısa süreli (15 dakikalık) maruziyetler için 2,0 ppm'lik bir maruziyet sınırı (70) belirtir. Formaldehit koku ile tespit edilebiliyorsa, muhtemelen maruz kalmanın kabul edilebilir sınırların ötesinde bir konsantrasyonda meydana geldiği anlamına gelir.
Aşağıdaki şekilde formaldehite maruz kalmayı sınırlayın.
- Fiksasyon için organların biriktirilebileceği tüm numune kovalarını örtün.
- Atılan formalinle ıslatılmış havluları ve diğer formalinle ıslatılmış atıkları hasılat masasında bir torbada toplayın. Dolduruldukça atığın üzerine periyodik olarak formalin nötrleştirici bir ajan püskürtün. Doldurulduğunda torbayı kapatın.
- Torbalı formalinle ıslatılmış havluları ve diğer atıkları ayak pedalı ile açılıp kapatılabilen astarlı bir kaba atın.
- Bir davlumbaz veya aşağı akım masasında büyük sabit organları kesin.
- Formaldehit maruziyetini değerlendirmek için formaldehit izleme rozetleri olan çalışanları ve yerleşik patologları periyodik olarak 8 saatlik ve en az 15 dakikalık süreler boyunca izleyin.
- Doku grütleyicilerinin uygun doku hasılat tekniğinde yetkin olduğundan emin olun.
5.4. Dışıntılar
- Küçük dökülmeler için nötralize edici, emici paspaslar kullanın. Nötralize edici reaktifler, tehlikeli formaldehit, glutaraldehit ve diğer aldehit çözeltilerinin bertaraf edilmesi için uygun, uygun maliyetli bir yöntem sağlar. Tehlikeli aldehitleri tehlikeli olmayan, aşındırıcı olmayan, toksik olmayan bir polimere ve suya dönüştürürler. Üretilen polimer, ABD tarafından tanımlandığı gibi tehlikeli bir atık değildir. Başlık 40 Federal Düzenlemeler Yasası (71). Bu nötralize edici ajanlar, bertaraf maliyetlerini azaltma ve daha güvenli bir çalışma ortamına katkıda bulunma eğilimindedir. Bazı durumlarda, kristal ürünlerle formaldehit atıkların işlenmesinden sonra, ortaya çıkan katı atıklar onaylanmış laboratuvar katı atık akışlarına atılabilir.
- Cilde maruz kalmayı önlemek için uygun koruyucu eldivenler ve koruyucu giysiler giyin. Koruyucu gözlük veya kimyasal güvenlik gözlüğü takın veya OSHA'nın göz ve yüz koruma yönetmelikleri (72) tarafından açıklandığı gibi tam yüz kalkanları kullanın.
5.5. Koruyucu Ekipman
5.5.1. Güvenlik ekipmanı
- Biyolojik güvenlik kabinleri (2,56), manipüle edilen malzemenin hacmini ve boyutunu barındırmadaki sınırlamaları nedeniyle otopsi süitlerinde yaygın değildir.
- Vakaya göre risk analizinde belirtildiği gibi, zoonotik ajanlardan şüphelenilen kadavraların nekropsileri için pratik olduğunda (küçük hayvanlar için) sınıf II BSC'ye sahip nekropsi tesislerini kullanın. Bununla birlikte, zoonotik ajanlardan şüpheli büyük hayvan kadavralarının nekropsisi BSC'lerde pratik olmadığından, KKD, mühendislik kontrolleri ve klinik laboratuvarlar için özel olarak geliştirilmiş prosedürleri kullanın.
- Kan yoluyla bulaşan patojenlere ve aerosoller tarafından bulaşan ajanlara maruz kalma riski olduğunda optimum koruma için, tüm otopsi/nekropsi tesisleri BSL-3 iş uygulamalarını ve fiziksel muhafazayı kullanabilmeli veya işi yapan bir tesise referans verebilmelidir (56,59).
- Temiz alanlardan kirli alanlara tek yönlü hava akışı sağlayın.
- Odanın diğer çevredeki odalara göre negatif basınç altında olduğundan ve saatte 11-12 hava değişimi ile emin olun.
- Hava doğrudan dışarıya havalandırılabilir veya HEPA filtreleri aracılığıyla odaya devridaim edilebilir, ancak havanın temiz çevredeki alanlara dolaşmasına izin vermeyin, çünkü bu M. tüberculosis enfeksiyonu salgınlarıyla ilişkilendirilmiştir.
- Otopsi/nekropsi paketinin yeniden tasarlanması durumunda, bulaşıcı dokulara maruz kalmayı azaltmak için bir BSC'nin yerleştirilmesini düşünün (56,73).
5.5.2. Otopsi/nekropsi personeli için KKD
- Kıyafet
— Sıvıya dayanıklı (cerrahi) tulum veya boyundan ayaklara ve kollara kadar örten gömlek ve pantolon
— Su geçirmez önlük ve su geçirmez kılıflar
— Sıvıya dayanıklı ayakkabı kılıfları veya patiklerle kaplı kapalı burunlu ayakkabılar
— Başı tamamen kaplayan cerrahi başlık veya başlık kaputu (yalnızca otopsi) - Sıçramalara ve aerosollere karşı koruma
— Genel otopsi için veya bir risk değerlendirmesi kadavradaki zoonotik ajanlar için yüksek bir olasılık olduğunu gösterdiğinde ve bir BSC'de nekropsi yapılamadığında, gözleri, ağzı ve boynu kaplayan şeffaf bir yüz siperi ve uyum testi yapılmış bir N95 solunum cihazı kullanın. Gözlükler ve kontakt lensler tek başına koruma için yeterli değildir.
— N95 solunum cihazı takamayan kişiler, motorlu hava temizleyici solunum cihazları (PAPR'ler) takmalıdır.
— Cerrahi maskeler, otopsi katılımcılarını enfeksiyöz solunabilir aerosoller veya tehlikeli kimyasal buharlar gibi havadaki kirleticileri solumaktan korumaz. (56,57,69,73,74). - Eldivenler
— Her saat eldiven değişikliği ile otopsi/nekropsi boyunca çift eldiven önerilir. Eldivenlerin yüzde sekizi otopsi sırasında delinir ve deliklerin yaklaşık üçte biri eldivenler çıkarılana kadar tespit edilmeden kalır (56,75).
— Otopsi için, kemik ve neşterlerden kesilmeleri önlemek için ince dokuma çelikten kesilmeye dayanıklı bir eldiven seçin ve kayma direnci için bunu kauçuk bir eldivenle örtün. Kesilmeye dayanıklı eldivenler iğne çubuklarından korumaz.
— Belirli bir göreve ve koşullara özel eldivenleri seçin. Örneğin, kimyasal maruziyet için ağır eldivenler veya iğneler kullanılacaksa kazara delinmeye dayanıklı eldivenler kullanın.
— Bir deliği fark ettikten hemen sonra eldivenleri değiştirin ve otopsi/nekropsiye devam etmeden önce ellerinizi sabun ve suyla yıkayın. - Kesikleri veya sıyrıkları su geçirmez tıkayıcı bandajlarla örtün.
- Mevcut ancak otopside doğrudan katılmayan personel, yani tıp öğrencileri/gözlemciler için KKD sağlayın. Gözlemciler, otopsi/nekropsiye katılanlarla aynı KKD'yi kullanacaklar.
- Tüm yüzeyler kontamine olarak kabul edilecektir.
5.6. Ekipman ve Aletler için Dezenfeksiyon ve Temizleme Prosedürleri
5.6.1. İnsan otopsisi
- Vücut sıvısı veya doku dökülmelerini hemen temizleyin. Dökülmeyi kağıt havlularla örtün ve bölgeyi bir dezenfektan veya deterjan çözeltisi ile doyurun veya bir paspas ve ardından dökülme alanının 1:10 ağartıcı çözeltisi ile dezenfekte edilmesi kullanın.
- Otopsiden sonra vücudun dekontaminasyonu için, vücudu bir deterjan çözeltisi, ardından bir antiseptik çözelti veya seyreltilmiş çamaşır suyu ile yıkayın. Vücudu sızdırmaz bir örtüye yerleştirin ve biyolojik tehlike olarak etiketleyin. Bilinen kanla bulaşan patojenler veya M. tuberculosis varlığı durumlarında mortisyenin doğrudan bildirimi uygundur.
5.6.2. İnsan otopsisi/hayvan otopsisi
Otopsi veya nekropsi sonrası dezenfeksiyon ve temizlik için aşağıdaki kılavuzlar her iki tür prosedür için de geçerlidir.
- Vücut, oda veya alet temizliği ile ilgili herkes uygun KKD'yi takmalıdır.
- Tüm çalışma yüzeylerini ve zeminleri bir deterjan çözeltisi ile yıkayın, ardından 1:10 çamaşır suyu çözeltisi veya diğer uygun ticari dezenfektan ile dezenfeksiyon yapın.
- Kimyasal dezenfeksiyon veya otoklavlamadan önce tek başlık olmayan aletlerden (bıçak kolları, tavalar, önlükler) görünür brüt dokuyu çıkarın. Keskin nesneleri delinmeye dayanıklı kaplara koyun ve kalan brüt dokuları çıkarmak için deterjan çözeltisi ile yıkayın. 1:10 çamaşır suyu çözeltisi veya uygun ticari dezenfektan, mevcut kan miktarına ve vücut sıvısına bağlı olarak hacim olan su ile iyice durulayın ve ıslatın. Ağartıcının paslanmaz çelik ve alüminyum cihazları aşındıracağını düşünün. Dezenfektanı veya ağartıcıyı suyla durulayarak çıkarın.
- Tek kullanımlık eşyaları, kağıt ürünleri, önlükleri, süngerleri ve benzeri eşyaları, terminal tedavisi veya otoklavlama için bir biyolojik tehlike kabına veya torbasına koyun.
- Yeniden kullanılabilir giysileri, hastane protokolüne göre çamaşır yıkamak için sızdırmaz bir biyolojik tehlike torbasına yerleştirin.
-
Önlükler gibi yeniden kullanılabilir, yıkanmayan maddeleri deterjan solüsyonu ile yıkayın, ağartıcı çözeltisi ile dekontamine edin, suyla durulayın ve bir sonraki kullanımdan önce kurumaya bırakın.
- Giysiler ve laboratuvar önlükleri de dahil olmak üzere otopside kullanılan hiçbir kirli eşya veya herhangi bir şey odadan çıkarılmayacaktır.
- Kamerayı, telefonları, bilgisayar klavyelerini ve diğer eşyaları mümkün olduğunca temiz tutun, ancak kirlenmiş olduğunu düşünün ve eldivenlerle tutun. Her kullanımdan sonra ürünleri deterjan çözeltisi ve 1:10 ağartıcı solüsyonu veya uygun dezenfektanla silin.
- Odadan çıkarken eldivenleri çıkardıktan sonra ellerinizi sabun ve suyla yıkayın.
5.7. Atık yönetimi
5.7.1. İnsan dokusu
Bu tehlikeli madde olarak kabul edildiğinden ve ABD tarafından düzenlendiğinden, tüm patolojik atıkları yakın. Ulaştırma Bakanlığı (DOT) veya patolojik atıkları, DOT gereksinimlerini karşılayan açıkça etiketlenmiş, özel, sızdırmaz kaplarda veya arabalarda saha içi veya tesis dışı arıtma tesislerine taşıma. DOT sharps atık konteynerlerinin bu gereksinimleri karşılamanın yanı sıra delinmeye karşı dayanıklı olması gerekir. Eyalet, yerel ve bölgesel düzenlemeler de geçerli olabilir ve ele alınması gerekebilir.
5.7.2. Hayvan dokusu
Vakaya göre risk analizi değerlendirmesi (yakma, otoklavlama ve standart atık bertarafı, işleme, kompostlama, kremasyon, özel gömme) tarafından belirlenen uygun bir yöntem kullanarak tüm hayvansal nekropsi atıklarını (dokular veya nekropsi kadavra) atın.
5.7.3. Diğer atıklar
Uygunsa otoklav kırmızı torba atıklarını parçalayın. Eyalet, yerel ve bölgesel düzenlemeler de geçerli olabilir ve ele alınması gerekebilir. (Bkz. Bölüm 3.5, Atık Yönetimi.)
5.8. Temiz ve Kirli Alanlar
Temiz alanlar idari bir alan ve duşlu banyolar içerebilir. Bu alanlardan gelen hava, otopsi paketinden (56,76,77) farklı şekilde tüketilmelidir. Diğer tüm alanlar kirli kabul edilir ve uygun KKD gereklidir.
5.9. Cerrahi Patoloji
- Cerrahi patoloji, brüt diseksiyon ve donmuş kesitlemeyi içerir. Histoloji ve sitoloji, otopsi ve klinik tanı laboratuvarlarının "hibrit" alanlarıdır. Her laboratuvar bölümünün kendine özgü güvenlik sorunları vardır; standartlaştırılmış biyogüvenlik uygulaması veya bildirilen biyogüvenlik olayları hakkındaki veriler çok sınırlıdır. Cerrahi patoloji güvenliğinde dokümantasyon ve araştırma, gelecekteki kılavuzlar ve öneriler için gereklidir (78,79).
- Cerrahi patoloji riskleri, bilinmeyen bulaşıcı kaynaklardan büyük miktarda taze dokuların manipüle edilmesiyle ilişkilidir, bu da taze organların hasılat masasında görülmesi ve fiksasyon için yeterince ince bölümlere ayrılması gereken otopsiye benzer şekilde, kan ve vücut sıvılarının delinmesine, kesilmesine ve sıçramasına neden olabilir (yani, "ekmek"). Diğer riskler, donmuş dokuyu bölerken enfeksiyöz aerosoller üreten kriyostat kesme ekipmanı veya dondurma spreyi kullanımı ve büyük miktarlarda formaldehite maruz kalmayı içerir.
- Slayt incelemesi için kullanılacak doku formalin içinde sabitlenir; daha sonra, ilgilenilen küçük doku bölümleri neşterlerle disseke edilir, kasetlere yerleştirilir, numune fıçılarına formalin ile değiştirilir ve histolojiye taşınır.
- Histoloji daha sonra formalinle sabitlenmiş dokuyu parafin içine gömer ve bu bölümleri mikrotom kanatlı aletlerle keserek belirli lekeler ve immünokimya kullanarak görüntüleme için slaytlar yapar. Çoğu formalin-fixed numune bulaşıcı olmasa da, hem M. tuberculosis hem de CJD ajanı, formalin-fixed, parafin-emedded materyalde bulaşıcı formda kalabilir. Toksik formaldehite maruz kalma yaygındır.
- Sitoloji, büyük ve küçük hacimli vücut sıvıları, kemik iliği örnekleri veya iğne aspire örnekleri alır, bunların çoğu fiksatif olarak alınır, ancak diğerleri büyük hacimli vücut sıvılarının alınması veya dökülmesiyle işlenmesi gerekir, bu da sıçrama ve dökülmelere neden olabilir. Santrifüjleme ve sitospin işleme gibi işlemler aerosol üretebilir. Air-dried slaytlar, sabitlenene ve lekelenene kadar bir kontaminasyon kaynağı olabilir.
5.9.1. Numune alma ve oturum açma
- Numuneleri standart önlemlerle tutun ve alırken ve katılırken eldiven giyin (2,57). Tüm cerrahi patoloji laboratuvarlarındaki makbuz alanları kirli alanlar olarak kabul edilir ve tüm dış kaplar kontamine olarak kabul edilir.
- Ameliyathaneden, otopsiden veya dış toplama alanlarından teslim edilen deri ve gastrointestinal biyopsiler de dahil olmak üzere örnekleri sızdırmaz kaplara veya toplama yerindeki fiksatif numune kaplarına koyun. Numuneyi ikincil bir sızdırmaz torbaya veya kaba koyun ve biyolojik tehlike olarak etiketleyin. Talebi, numune ile kontaminasyonu önleyeceği bir dış cebe yerleştirin.
- Sızıntılı numuneler veya gözle görülür şekilde kontamine numuneler
Numuneler taze doku, kan veya formalin ile kontamine olabilir. İşleme, numunenin taze mi yoksa formalinle sabitlenmiş mi olduğuna bağlıdır.
— Numune fiksatifte gönderilirse ve ikincil kap sızdırmıyorsa, numune kapağını sıkın ve birincil kabı temiz bir torbaya koyun; tezgah üstünden herhangi bir formalin silin.
— Numune taze doku olarak gönderilirse ve dış kap sızdırıyorsa, numuneyi başka bir kaba koyun ve uygun KKD kullanarak işleyin. Numuneler daha sonra temiz bir kaba aktarılacak ve etiketlenecektir.
— Eğer talep kirlenmişse, biyolojik olarak tehlikeli atık olarak atın ve değiştirin.
5.9.2. Açık bankta çalış
- Aynı açık alanda taze doku veya kriyostatlar kullanılıyorsa, oturum açma odası ve idari alanları hasılat odasından ayırın (56,76,77).
- Taze dokunun işlenmesi
— Mümkünse bir BSC'de veya cerrahi patoloji hasılat istasyonlarının geri kalanından ayrılmış bir odada taze dokuyu inceleyin. Kan hacmine ve vücut sıvısına maruz kalma olasılığına bağlı olarak otopsi koşullarına benzer bir N95 maskesi ve diğer KKD kullanın (56). Taze doku asla eldivensiz ele alınmamalıdır. Otopsi prosedürlerinde kullanılan KKD, taze dokunun işlenmesinde savunulmaktadır (2,56,57,80,81).
— İnsan patolojisi için, fiksasyona tabi olmayan veya yeterince sabitlenemeyen (örneğin, dişler veya yabancı cisimler) taze dokuları çift, kapatılabilir, sızdırmaz bir kapta saklayın; biyolojik tehlike olarak etiketleyin ve bir buzdolabında veya dondurucuda saklayın (2).
— Kan yoluyla bulaşan enfeksiyonlara karşı standart önlemler, klinik öyküden bağımsız olarak kullanılmalıdır (79). - Donmuş bölümler
— Dondurulmuş kesitleme taze doku üzerinde yapılır ve bulaşıcı maruz kalma için yüksek riskli bir prosedürdür. Dondurulan doku organizmaları öldürmez ve kriyostat kesme bıçağının kullanımı potansiyel olarak tehlikeli aerosoller oluşturur. Cerrahi ekiple donmuş kesit için gerçek klinik gerekliliği tartışın.
— Bazı kriyostat cihazları cihaza bir aşağı akımına sahip olsa da, aerosoller kesimin gerçekleştiği odaya dağıtılır. Dondurma işlemini birkaç saniye hızlandıran ve sadece dondurulan dokunun değil, aynı zamanda cihazın tabanında bulunan önceden kesilmiş örneklerden alınan dokuların da aerosolleşmesine neden olan dondurucu itici spreyler kullanmayın. Bu tür prosedürler aerosol ve damlacık kontaminasyonuna neden olarak bölgedeki tüm personel için bulaşıcı bir risk oluşturur (56,79,82). Klinik ve Laboratuvar Standartları Enstitüsü ve diğerleri, kriyostat enstrümantasyonu üreticileri tarafından önerilmediği için dondurma spreylerinin kesilmesini tavsiye etmiştir (2,79).
— İdeal olarak, cerrahi patoloji paketinin geri kalanına kontaminasyonu önlemek için doğrudan dışarıya havalandırılan veya bir HEPA filtre ile devridaim edilen kapalı bir odada kriyostat kullanın.
— Bazı kriyostatlarda ultraviyole ışıklar bulunur, ancak bunlar cihazın terminal temizliğinin yerine geçmez ve mikobakterilerin öldürülmesinde etkisizdir.
— İnsan patoloji laboratuvarlarında, işlem yaparken eldiven, yüz siperliği veya gözlük ve N95 maskesi takılmalıdır. - Kemik kesme. Bkz. Otopsi Bölüm 5.2.2.
- Sabit doku
— Etkili fiksasyon sağlamak ve bulaşıcı kontaminasyon potansiyelini azaltmak için dokuyu %10 formalin içinde doku hacminin 10 katı bir konsantrasyonda sabitleyin. Bununla birlikte, bulaşıcı organizmaların canlılığı, açıkça tanımlanmamış bir dizi değişkene bağlıdır ve sabit dokunun bulaşıcı kaldığı gösterilmiştir (78). M. tuberculosis sabit numunelerden ve sabit numunelerden büyütülmüşten bulaşmıştır ve CJD rutin formalin konsantrasyonu tarafından inhibe edilmez. Formalin ile sabitlenmiş numunelerin kesildiği brüt istasyonları, formaldehit dumanını azaltmak için tasarlanmıştır, ancak BSC'ler değildir (2,57,83–85). Formalin-sabit numuneler eldivenle kullanılmalıdır.
— Sabit doku ile tüm çalışmalarda standart önlemler ve uygun KKD kullanın. Formalin sıçraması muhtemelse, yüz siperleri tam yüz ve boyun koruması için en uygunudur. Kalkanlar, kullanıcının reçeteli gözlük takmasına veya dikte etmesine izin verirken uzun süreler için en fazla konforu sunar.
— Gözlükler ve kontakt lensler göz korumasının yerine geçmez.
— Gözlükler ve sıvıya dayanıklı maske alternatif bir seçimdir ancak tercih edilmez.
— Dekontamine edilebilen veya tek kullanımlık yüz siperleri/gözlükler kullanın.
— Maruz kalma dumanlarını azaltmak için formalin içinde mendil içeren kapları kapalı tutun. - Sitoloji örnekleri
— KKD numuneye bağlıdır. Slaytlar sabitlenene ve lekelenene kadar tüm numuneler için eldiven ve laboratuvar önlüğü gereklidir.
— Bir BSC içinde sıçrama ve/veya aerosolizasyon potansiyeli olan büyük hacimli örnekleri dökün veya aliquot ve sıvıya dayanıklı giysiler, önlük ve iki çift eldiven giyin.
— Bir BSC'deki tüplere gönderilen küçük hacimli vücut sıvılarını veya aspiratları açın veya sıçramayı ve dökülmeyi önlemek için dökmek yerine tek kullanımlık bir pipetli bir sıçrama koruyucusu veya yüz siperi ve aliquiquot kullanın.
— Fiksatiflerin toksisitesi ve olası dış kontaminasyon nedeniyle eldivenli fiksatif olarak alınan sap örnekleri (57). Slayt hazırlığı bir sitospin preparatı kullanacaksa, sistem güvenlik kapaklı ve dış kapaklı bir kase içermelidir.
— Tüm slaytları, izlenim lekelerini, sitolojik preparatları ve kemik iliği lekelerini sabit ve lekelenene kadar bulaşıcı olarak düşünün.
Sıvıların santrifüjlenmesi için O-ringli ve sızdırmaz üstleri olan güvenlik kapları olan bir güvenlik santrifüjü kullanın (51). - Dekontaminasyon
— Kriyostat. Kesimle üretilen alet talaşları kontamine olarak kabul edilir. Birikmiş kesimleri toplayın ve biyolojik olarak tehlikeli atık olarak atın. Cihazı çözün ve günlük olarak %70 alkol ile dekontamine edin. Bir tüberkülosidal dezenfektanla veya bilinen bir M. tüberküloz enfeksiyonu vakasından sonra haftalık olarak dekontamine edin. Mikrotome bıçaklarını temizlerken paslanmaz çelik örgü eldiven giyin.
— Mikrotom. Kriyostatlarda olduğu gibi benzer bir program düşünün.
— Eldiven kullanan herhangi bir kişi bu eşyalara dokunursa, tüm yüzeyleri, bilgisayarı, telefonu ve tezgahları kontamine olarak düşünün. Ekipmanı ve tezgahları günlük olarak dezenfekte edin.
— Çeşitli laboratuvar odalarından çıkmadan önce eldivenleri çıkarın ve ellerinizi sabun ve suyla yıkayın.
5.9.3. Laboratuvarın temiz ve kirli alanları
Tüm cerrahi patoloji uzmanlık alanları (sitoloji, histoloji, hasılat veya donmuş bölüm odaları), taze örnekler veya vücut sıvıları açık bir odada alınırsa veya işlenirse (bir BSC'de veya ayrı olarak havalandırılan alanda değil) kirli alanlar olarak kabul edilir.
5.9.4. Doku lekeleri
Histoloji ve sitolojide çoklu boyama işlemleri yapılır. En yaygın olanlar buraya dahil edilmiştir. Bu lekelerin bir kısmı etanol, bir kısmı ise atıkları için yönetim seçenekleri üzerinde etkisi olabilecek metanol ile hazırlanır. Laboratuvardaki her bileşen için malzeme güvenlik bilgi formları (MSDS) sağlayın.
- Hematoksilin boyası
Hematoksilin boyası, Çevre Koruma Ajansı düzenlemeleri uyarınca tehlikeli değildir. Drenaj bertarafı, yerel atık su arıtma yetkililerinin izniyle tavsiye edilir. Federal, eyalet ve yerel düzenlemeleri takip edin. - Giemsa lekesi
Geimsa boyası için tercih edilen bertaraf yöntemi, izin verilen tehlikeli atık arıtma tesisinde yakmadır. Yerellikler, kanalizasyondan temizlenebilecek alkol miktarlarını kısıtlayabilir; uygun yetkililere danışın. Tüm yerel, eyalet ve federal hükümet düzenlemelerine uyumu sağlayın. - Wright lekesi
Wright lekesi, listelenen tehlikeli bir atık olan metanol içerir. Listelenen tehlikeli atıkların kanalizasyondan bertaraf edilmesi kabul edilemez veya kabul edilemez. Tercih edilen bertaraf yöntemi yakmadır. Tüm hükümet düzenlemelerine uyumu sağlayın.
5.9.5. Fiksatifler
- Formalin (HCHO)
— Formaldehit %37-%40 HCHO çözeltisi olarak satın alınabilir. En yaygın formaldehit preparatı, ticari olarak temin edilebilen %10 formalin (%3,7–4 formaldehit) oluştur. Maruziyeti sınırlamak için formalin veya formaldehitin seyreltilmesi önerilmez. Yerel yönetimler genellikle kanalizasyona atılabilecek aldehit miktarlarını kısıtlar. Her laboratuvar tüm devlet düzenlemelerine uymalıdır.
— Nötralizasyon, formaldehit için tercih edilen bertaraf yöntemidir. Nötralize edici reaktifler, formaldehit, glutaraldehit ve diğer aldehit çözeltilerinin atılması için uygun, uygun maliyetli bir yöntem sağlar. Tehlikeli aldehitleri tehlikeli olmayan, aşındırıcı olmayan, toksik olmayan bir polimere ve suya dönüştürürler. Üretilen polimer, ABD tarafından tanımlandığı gibi tehlikeli bir atık değildir. Federal Düzenlemeler Kanunu, Başlık 40 (71). Bu nötralize edici ajanlar, bertaraf maliyetlerini azaltma ve daha güvenli bir çalışma ortamına katkıda bulunma eğilimindedir. Bazı durumlarda, kristal ürünlerle formaldehit atıkların işlenmesinden sonra, ortaya çıkan katı atıklar onaylanmış laboratuvar katı atık akışlarına atılabilir. Nötralize formalin çözeltilerinin kanalizasyon bertarafına başlamadan önce, geçerli yerel atık su yetkililerinin resmi onayını aldığınızdan emin olun.
— Cilde maruz kalmayı önlemek için uygun koruyucu eldivenler ve koruyucu giysiler giyin. OSHA'nın 29 CFR 1910.133 (72) veya Avrupa Standardı EN166'daki göz ve yüz koruma yönetmeliklerinde açıklandığı gibi koruyucu gözlük, kimyasal güvenlik gözlüğü veya tam yüz kalkanları takın. Formalin ile çalışırken kontakt lens takmayın. Çalışma alanında göz yıkama çeşmesi ve sırılsıklam tesislerini koruyun. - Diğer patoloji fiksatifleri
— Fiksatifler düzenlenmiş atık olarak sınıflandırılır. OSHA'nın Standart, Kanlı Patojenler, 29 CFR Bölüm 1910, 1048 ve 1030, patoloji örneklerinin tüm içeriği içerecek ve taşıma, depolama, taşıma veya nakliye sırasında sıvıların sızmasını önleyecek şekilde inşa edilmiş ikincil kaplara yerleştirilmesini zorunlu kılar (33,70).
— İkincil kapları biyolojik tehlikeler olarak etiketleyin ve taşıma, depolama, nakliye ve nakliye sırasında içeriğin dökülmesini önlemek için çıkarmadan önce kabı güvenli bir şekilde kapatın. - Ksilenler ve alkoller
— Ksilen, EPA tarafından Kaynak Koruma ve Geri Kazanım Yasası (RCRA) kapsamında tehlikeli atık olarak sınıflandırılır ve EPA tehlikeli atık no. U239. Atık ksilen, damıtma yoluyla çözünmüş parafinden ayrılabilir ve ticari olarak temin edilebilen geri dönüşüm üniteleri, yeniden kullanılabilir ksilen üretmek için bu ayrıştırmayı etkili bir şekilde gerçekleştirebilir. Ksilen ayrıca, 40 CFR 264.316 veya 265.316 (71) gerekliliklerini karşılayan organik bir metalik veya organik laboratuvar paketinde bulunuyorsa, uygun şekilde izin verilen bir tehlikeli atık yüklenicisi tarafından bertaraf edilebilir.
— Geri kazanım veya geri dönüşüm için kaydedilemeyen ksilen, tehlikeli atık olarak işlenmeli ve RCRA onaylı bir yakma fırınasına gönderilmeli veya RCRA onaylı bir atık arıtma tesisine atılmalıdır. Bu ürünün işlenmesi, kullanılması veya kontaminasyonu atık yönetimi seçeneklerini değiştirebilir. Eyalet ve yerel imha düzenlemeleri, federal elden çıkarma düzenlemelerinden farklı olabilir. Konteyneri ve kullanılmayan içerikleri federal, eyalet ve yerel gerekliliklere uygun olarak atın.
— Alkoller (etil alkol, izopropil alkol, metil alkol) için bertaraf kılavuzları ksilen için olanlarla aynıdır. - Formalin ve ksilen maruziyeti için test
Rutin olarak maruz kalan kişiler (örneğin, teknoloji uzmanları, doku hasıratçısı, yerleşik patologlar) için formaldehit maruziyetini değerlendirmek için 8 saatlik ve en az bir 15 dakikalık bir süre boyunca periyodik olarak kimyasal rozetlerle periyodik testler yapın ve her iş istasyonunun değerlendirilmesi için çeşitli alanlar arasında döndürün.
5.10. Mühendislik Kontrolleri ve Tesis Yenilemeleri
Otopsi ve anatomik patoloji laboratuvarının taze doku ve vücut sıvılarını işleyen diğer alanlarını güncellerken veya yenilerken aşağıdakiler dikkate alınmalıdır.
- Taze numunelerin işlenmesi için BSC'ler mevcut değilse veya kriyostatlar idari personelle aynı alandaysa, numuneleri almak için kapalı numune alma/idari alanlar tasarlamak.
- Odaların çevredeki odalara göre negatif hava akışı sağlanması.
- Taze dokuları işlemek için bir BSC kurmak.
- Cerrahi hasılat süitinin geri kalanı dışında kriyostatlar ve kemik testereleri için ayrı bir oda sağlanması.
5.11. Creutzfeldt-Jakob Hastalığı
Olası CJD vakalarının işlenmesinde otopsi ve otopsi paketi dekontaminasyonu, beyin kesme ve histolojik doku hazırlama prosedürleri için özel önlemler gereklidir (1,56,65,67,86).
5.11.1. Otopsi
BSL-3 tesis ventilasyon ve solunum önlemleri ile artırılmış BSL-2 önlemlerini kullanarak otopsiler gerçekleştirin. Standart otopsi KKD giyin. Otopsiyi beyin çıkarılması ile sınırlayın. Katılımcıları yalnızca gerekli olanlarla sınırlayın. Beyni double-bag ve dondurmak için plastik bir kaba koyun veya kesitlendikten sonra %3,7-%4 formaldehit içinde sabitleyin. Formaldehit fiksasyonu, histolojik bölümler toplanmadan önce 10-14 gün boyunca gerçekleşir.
5.11.2. Histolojik preparatlar
- Prionlar formalin fiksasyonu ve parafin gömmeden sonra bulaşıcı kalır. (56,64,66,86).
- KKD, eldiven, laboratuvar önlüğü, önlük ve yüz korumasını içerir.
- Histolojik slayt hazırlığından önce, <5 mm kalınlığındaki küçük beyin dokusu blokları 1 saat boyunca %95-%100 formik aside batırılır ve ardından en az 48 saat taze %4 formaldehit içine batırılır. Bu tür dokular ya elle ya da makine ile işlenebilir. Bloklar ve slaytlar daha sonra rutin olarak ele alınabilir. Laboratuvar elle işlem yapmayı tercih ediyorsa, prosedürler işlenmemiş dokularla aynıdır.
- Doku gömmeden önce formik asit ile ön işlemden geçirilmemişse, kesitleme de dahil olmak üzere çift eldiven ve göz koruması her zaman giyilmelidir. Su yıkamaları da dahil olmak üzere tüm çözeltiler toplanır ve eşit miktarda taze, seyreltilmemiş çamaşır suyu veya 1N NaOH ile 60 dakika boyunca işlenir. Tek kullanımlık malzemeler ya yakılır ya da uygun sıcaklık ve basınçta otoklavlanır (1,56,86). Züccaciye ve aletler genellikle seyreltilmemiş çamaşır suyuna 1 saat batırılır ve ardından iyice durulanır. Alet için uygunsa, uygun sıcaklık ve basınçta otoklavlanabilirler. Islatılamayan veya otoklavlanamayan ekipmanlar seyreltilmemiş çamaşır suyu ile silinmeli ve 30 dakika bekletilmelidir.
- Tüm parafin artıklarının ve kullanılmayan bölümlerin tek kullanımlık bir tabaka üzerinde toplanmasına özen gösterilmelidir. Mikrotomun kendisi ağartıcı veya sodyum hidroksit çözeltisi ile silinebilir, ancak tamamen dekontamine edilemez. Sık olası CJD vakaları ele alınırsa, laboratuvarlar eski bir mikrotomu bu amaca adamak isteyebilir.
- Tüm atıklar toplanacak ve bertaraf edilecektir. Bıçak bıçağını keskin bıçaklarla birlikte atın.
- İşlenmemiş doku içeren slaytlar, tek kullanımlık numune kaplarında veya Petri kaplarında elle boyanır. Slaytlar bulaşıcı CJD olarak etiketlenir ve uygun şekilde etiketlenmiş bir kapta saklanır/dosyalanır. Kesitli blok parafin ile kapatılmıştır.
- Doku kalıntıları, yakma için bulaşıcı hastane atığı olarak atılır. Sıvılar, atılmadan önce 1 saat boyunca seyreltilmemiş ağartıcı ile 1:1 seyreltilir.
- Yerel yargı bölgelerine bağlı olarak özel ekipman gerekebilir.
6. Parazitoloji Laboratuvarı
Teşhis prosedürleri sırasında bulaşıcı parazitlere maruz kalma, örneklerin işlenmesinden, kan alınmasından, çeşitli konsantrasyon prosedürlerinin gerçekleştirilmesinden, organizmaların kültürlenmesinden ve hayvan aşılama çalışmalarının yürütülmesinden kaynaklanabilir. İlgili parazitler ve olası enfeksiyon yolları Tablo 7 ve Kutu 1'de listelenmiştir. Tablo 8, antiseptiklere ve dezenfektanlara karşı direnç hakkında bilgi içermektedir.
6.1. Numune Alma ve Oturum Açma/Kurulum İstasyonu
- Taze örnekler (dışkı, diğer gastrointestinal sistem örnekleri, idrar, kan, dokular, beyin omurilik sıvısı, diğer vücut sıvıları, eklembacaklılar) potansiyel bir bulaşıcı parazit kaynağını temsil eder.
- Güvenlik önlemleri arasında fiksatiflerin uygun şekilde etiketlenmesi; numune kullanımı için belirli alanların belirlenmesi (biyolojik güvenlik dolapları belirli koşullar altında gerekli olabilir); santrifüjleme için uygun kaplar; kabul edilebilir atma politikaları; çalışma alanlarında yeme, içmeme veya sigara içmeme için uygun politikalar; ve varsa, organizma kültürü ve/veya hayvan aşılaması için doğru teknikler.
- Her numuneyi güvenli bir kapaklı sızdırmaz bir birincil kaba toplayın veya aktarın (çıtçıtlı kapaktan kaçının).
- Mümkün olduğunda talep fişi ve numune için ayrı cepli tek kullanımlık plastik torbalar kullanın (2,87).
6.1.1. Sızıntılı kaplar
- Tüm numune kaplarını sızıntı açısından görsel olarak inceleyin.
- Kirlenmiş birincil kaplar daha fazla manipülasyondan önce dekontamine edilmelidir. Bazı durumlarda, test alanına teslim edilmeden önce içeriğin temiz bir kaba aktarılması veya başka bir numunenin toplanması gerekebilir.
- Kirlenmiş talepleri biyolojik olarak tehlikeli atık olarak atın ve değiştirin.
6.1.2. Gevşek kapaklar
- Kan örnekleri tüplerde, genellikle Vacutainer tüplerinde (lavanta veya yeşil üstlerle) gönderilir. Tıpa gevşek görünüyorsa veya tüpün dışında kan kanıtı varsa, güvenli bir şekilde oturması için tıpayı tüpe itin ve gönderenden başka bir örnek göndermesini isteyin. Numune tekrarlanamıyorsa, numuneyi işlemeden önce dışını dekontamine edin.
6.2. Lekeler ve Reaktifler (88,89)
6.2.1. Trikrom lekesi
- Wheatley'in Gomori dokusu trikrom boyasını modifikasyonu tehlikeli olmayan atık olarak kabul edilir, ancak federal, eyalet ve yerel çevre kontrol düzenlemelerine uygun olarak bertaraf edilmelidir.
- Drenaj bertarafı, yerel atık su arıtma yetkililerinin izniyle tavsiye edilir.
6.2.2. Hematoksilin boyası
- Hematoksilin boyası Çevre Koruma Ajansı (EPA) düzenlemeleri kapsamında tehlikeli değildir.
- Drenaj bertarafı, yerel atık su arıtma yetkililerinin izniyle tavsiye edilir. Kanada imha düzenlemeleri genellikle Amerika Birleşik Devletleri'ndekilere paraleldir.
- Federal, eyalet ve yerel düzenlemelere uyun.
6.2.3. İyot
- Sıvı ve iyotla kirlenmiş parazitoloji ile ilgili tüm materyalleri Ulaştırma Bakanlığı (DOT) onaylı atık kaplarına atın.
- Sıvılar için yakma, önerilen bertaraf yöntemidir.
- Bertaraf için tüm federal, eyalet ve yerel düzenlemelere uyun.
6.2.4. Asit-hızlı lekeler (modifiye edilmiş)
- Geçerli federal, eyalet ve yerel gerekliliklere uygun olarak konteyner ve kullanılmayan içerikleri atın.
- Eyalet ve yerel elden çıkarma düzenlemesi, federal elden çıkarma düzenlemelerinden farklı olabilir.
6.2.5. Giemsa lekesi
- Tercih edilen bertaraf yöntemi, izin verilen bir tehlikeli atık arıtma tesisinde yakmadır.
- Yerler, kanalizasyona atılabilecek alkol miktarlarını kısıtlayabilir. Tüm hükümet düzenlemelerine uyumu sağlayın.
6.2.6. Wright lekesi
- Tercih edilen bertaraf yöntemi, onaylanmış bir tesiste yakmadır.
- Yerler, kanalizasyona atılabilecek alkol miktarlarını kısıtlayabilir. Yürürlükteki tüm hükümet düzenlemelerine uyumu sağlayın.
6.2.7. Formalin (HCHO)
- Formaldehit normalde %37-40 HCHO çözeltisi olarak satın alınır; ancak seyreltme için %100 olarak kabul edilmelidir. Yaygın olarak iki konsantrasyon kullanılır: Protozoan kistlerin korunması için önerilen %5 ve helmint yumurtaları ve larvalar için önerilen %10. %5 genellikle çok amaçlı kullanım için tavsiye edilse de, çoğu ticari üretici %10 sağlar, bu da tüm helmint yumurtalarını öldürme olasılığı daha yüksektir. En yaygın formalin preparatı %10 formalindir.
- Yakma, formaldehit için tercih edilen bertaraf yöntemidir.
- Yerel yönetimler genellikle kanalizasyona atılabilecek aldehit miktarlarını kısıtlar. Her laboratuvarın tüm hükümet düzenlemelerine uyması gerekecektir.
- Tehlikeli formaldehiti atmak için nötralize edici reaktifler kullanın. Ticari bileşikler ve güvenli aldehit çözeltileri kullanılmalıdır. Glutaraldehit ve diğer daha tehlikeli aldehitleri tehlikeli olmayan, aşındırıcı olmayan, toksik olmayan bir polimer ve suya dönüştürürler. Üretilen polimer, ABD tarafından tanımlandığı gibi tehlikeli bir atık değildir. Başlık 40 CFR 261.24(a) (71). Bu nötralize edici ajanlar, bertaraf maliyetlerini azaltma ve daha güvenli bir çalışma ortamına katkıda bulunma eğilimindedir.
- Bazı durumlarda formaldehit atıklarının kristal ürünlerle işlenmesinden sonra, ortaya çıkan katı atık onaylanmış laboratuvar katı atık akışlarına atılabilir. Nötralize formalin çözeltilerinin kanalizasyon bertarafına başlamadan önce, yerel atık su arıtma otoritesinden resmi onay alın.
- Cildin maruz kalmasını önlemek için koruyucu eldivenler ve koruyucu giysiler giyin. Formalin içeren flakonlardan numuneleri çıkarırken biyolojik bir güvenlik kabini (BSC) kullanılmıyorsa, koruyucu gözlük veya kimyasal güvenlik gözlüğü takın ve 29 CFR 1910.133 (72) veya Avrupa Standardı EN166'da Mesleki Güvenlik ve Sağlık İdaresi'nin (OSHA) göz ve yüz koruma düzenlemeleri tarafından açıklandığı gibi yüz siperleri kullanın.
- Çalışma alanında Amerikan Ulusal Standartlar Enstitüsü (ANSI) spesifikasyonlu göz yıkama istasyonunu ve sıslatma tesislerini koruyun.
6.2.8. Cıva bazlı fiksatifler
- Kimyasal analizde cıva kullanımı, tüm parazitoloji laboratuvarlarında olmasa da çoğunda aşamalı olarak kaldırılabilir. Mükemmel, güvenli ticari ürünler artık Zenker çözeltisi, histolojik fiksatifler ve daha önce cıva kullanımını gerektiren diğer ürünler gibi fiksatiflerin yerini alabilir. Bakır, kalay, çinko ve krom bileşikleri gibi bazı ikamelerin de bir miktar riski vardır, ancak cıva ile ilişkili olandan daha azdır.
- Geri dönüşüm şirketleri, laboratuvar çözümleri de dahil olmak üzere cıva içeren atıkları kabul edebilir veya etmeyebilir. Şirketler kabul edilen cıva atığının türü ve nakliye gereklilikleri (90–98) bakımından farklılık göstermektedir.
6.2.9. Çinko bazlı fiksatifler (formalin içeren)
- Çinko bazlı fiksatifler genellikle EPA tarafından tehlikeli atık olarak kabul edilmez (Kaynak Koruma ve Geri Kazanım Yasası [RCRA] kapsamında) ve artık cıva bazlı bileşikler içerenler için iyi ikameler olarak kabul edilir. Bu cıva ikameleri, ticari olarak mevcut detoksifikasyon ürünlerinden biriyle nötralize edilmedikçe katı atıklarla birlikte bertaraf edilmemelidir (71,99).
- Malzemeleri federal (40 CFR 261) (71), eyalet ve yerel gerekliliklere uygun olarak atın.
- Önerilen temizlik maddesi sudur.
- Çinko formalin, formaldehit içeriği nedeniyle toksiktir. Lisanslı bir atık nakliyesi kullanarak imha edin. Atık nakliyeciniz tarafından talimat verilmedikçe atık akışlarını karıştırmayın. Bazı atık su arıtma yetkilileri, çinko içeriği <600 ppm ise, sınırlı miktarlarda drenaj bertarafı için izin verebilir.
- Çinko formalin geri dönüştürülebilir ve piyasada bulunan detoksifikasyon ürünleri ile nötralize edilebilir.
- Formalin içermeyen çinko bazlı fiksatifler artık mevcuttur. Total-Fix gibi evrensel fiksatifler cıva, polivinil alkol veya formalin içermez ve test için taze veya dondurulmuş numuneler gerektiren Entamoeba histolytica ve Entamoeba histolytica/E. dispar grubu hariç, konsantrasyon, kalıcı lekeli smearler ve dışkı immünoassaylar için kullanılabilir. Giardia ve Cryptosporidium spp. testleri taze ve korunmuş örnekler üzerinde de çalıştırılabilir. Malzemeleri federal (40 CFR 261) (71), eyalet ve yerel gerekliliklere uygun olarak atın.
6.2.10. Bakır bazlı fiksatifler (formalin içermez)
- Birçok yerleşim bölgesi, drenajda yıkanabilecek bakır bileşiklerinin miktarını kısıtlar.
- Tüm hükümet düzenlemelerine uyumu sağlayın.
6.2.11. Ksilen ve alkoller
- Ksilen, RCRA kapsamında tehlikeli atık olarak sınıflandırılır ve EPA tehlikeli atık no. U239. Ksilen için mevcut ticari ikamelerden birinin kullanılması, burada açıklanan tehlikeli atık yönetimi için gerekli olan özel işlemeyi ele alma ihtiyacını ortadan kaldıracaktır.
- Ksilen, 40 CFR 264.316 veya 265.316 (71) gerekliliklerini karşılayan bir organometalik veya organik laboratuvar ambalajına atılabilir. Ksilen, yeniden kullanılabilir ksilen üretmek için piyasada bulunan çeşitli geri dönüşüm üniteleri kullanılarak damıtılabilir.
- Geri kazanım veya geri dönüşüm için kaydedilemeyen ksilen, tehlikeli atık olarak işlenecek ve RCRA onaylı bir yakma tesisine gönderilecek veya RCRA onaylı bir atık tesisine atılacaktır.
- Bu ürünün işlenmesi, kullanılması veya kontaminasyonu atık yönetimi seçeneklerini değiştirebilir. Eyalet ve yerel imha düzenlemeleri, federal elden çıkarma düzenlemelerinden farklı olabilir. Konteyneri ve kullanılmayan içerikleri federal, eyalet ve yerel gerekliliklere uygun olarak atın.
- Alkoller için bertaraf yönergeleri (etil alkol, izopropil alkol, metil alkol) ksilen için olanlarla aynıdır.
6.3. Bankta Çalışmak
- Genel olarak, mikrobiyoloji laboratuvarlarında kullanılan aynı önlem ve uygulamalar, özellikle aerosol bulaşması ile ilgili olarak tanısal parazitoloji prosedürlerine uygulanabilir (2,33).
- Numune toplama ve işleme için yönergeler, standart önlemlerin yanı sıra onaylanmış yöntemlere göre önerilen ekipmanın kullanımını içerir (örn. BSC'ler, davlumbazlar, santrifüjler, kesici aletler, cam eşyalar) (2,100,101).
6.4. Kişisel Önlemler
6.4.1. Davlumbaza karşı biyolojik güvenlik kabini
- Formalin içeren dışkı numuneleri işlenirken davlumbaz kullanımı zorunlu olmasa da, OSHA uyumlu bir formalin izleme programı kullanın.
- Ksilen dışındaki dehidrasyon reaktiflerinin ikame edilmesinde bile dışkı ve çözücü kokularını gidermek için davlumbazlar önerilir. Küçük, masa üstü bir model kabul edilebilir.
- Parazitoloji laboratuvarında dışkı örneklerinin işlenmesi için bir BSC gerekli değildir; ancak bazı laboratuvarlar, tüm korunmamış numuneleri işlemek için Sınıf I (açık yüz) veya birçok durumda Sınıf II-A2 (laminar-flow) BSC kullanır.
- Özellikle laboratuvar taze örnekleri işliyorsa veya parazit izolasyonu için kültürler yapıyorsa bir BSC önerilir (Tablo 7).
6.4.2. Kişisel koruyucu ekipman
- Bir tanısal parazitoloji laboratuvarında laboratuvar çalışmaları için uygun el hijyeni (yıkama ve antiseptikler) kullanın.
- Özellikle kan, vücut sıvıları ve dışkı örneklerini (100,101) kullanırken, parazitolojik inceleme için tüm örneklerin katılımı ve işlenmesi sırasında tek kullanımlık lateks, vinil veya nitril eldivenleri giyin; bu öneri, klinik numunelerin taze mi yoksa dışkı koruyucularında mı sunulduğunu geçerlidir. Eldiveni çıkardıktan sonra daima ellerinizi yıkayın.
6.4.3. Bağışıklama
- Bağışıklama Uygulamaları Danışma Komitesi, işle ilgili faaliyetleri bir sağlık veya laboratuvar ortamında kana veya diğer potansiyel olarak bulaşıcı vücut sıvılarına maruz kalmayı içeren tüm kişilerin hepatit B aşısı almasını tavsiye eder. Booster dozları önerilmemektedir (102).
- Hepatit B aşısı veya sapması ile ilgili imzalı ifadeler ve kayıtlar da dahil olmak üzere belgeler saklanmalıdır.
6.4.4. Dezenfeksiyon
Mikrobiyoloji laboratuvarı için genel öneriler, tanısal parazitoloji bölümünde kullanım için yeterlidir; bunlar tezgahların, telefonların, bilgisayarların, ekipmanların ve eller serbest telefonların dezenfeksiyonu için kılavuzları içerir.
6.5. Laboratuvarın Kirli ve Temiz Alanları
Mikrobiyoloji laboratuvarı için genel kılavuzlar, laboratuvarın parazitoloji bölümü için de geçerlidir. Özel bir öneriye gerek yoktur.
6.6. Enstrümantasyon
Aletlerin kullanımı için güvenlik gereklilikleri, genel bir mikrobiyoloji laboratuvarı için kullanılanlarla aynıdır ve öncelikle numune işleme ile ilgilidir.
6.7. Antikor ve Antijen Parazitolojisi Testi
Antikor ve antijen testi için güvenlik gereklilikleri, genel bir mikrobiyoloji veya immünoloji laboratuvarı için kullanılanlarla aynıdır ve öncelikle numune işleme ile ilgilidir.
7. Mikoloji Laboratuvarı
Kesin bir gereklilik olmasa da, filamentli mantarları kültürleyen ve bu organizmaları manipüle eden mikoloji laboratuvarlarının, ana laboratuvardan odaya negatif hava basıncı ile ana mikrobiyoloji laboratuvarından ayrı ve izole edilmesi önerilir. Sınıf II biyolojik güvenlik kabinine (BSC) doğrudan erişim, mikoloji çalışmasının ayrı bir odada veya ana laboratuvarın izole bir bölümünde yürütülmesi bu aktivite için kritik öneme sahiptir. Çoğu mikoloji tanı çalışması biyogüvenlik seviyesi (BSL)-2 laboratuvarında yürütülebilir.
7.1. Numune Alma ve Oturum Açma/Kurulum İstasyonu
7.1.1. Sızıntılı kaplar
Genel mikrobiyoloji laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir. Özel bir öneriye gerek yoktur.
7.1.2. Konteyner dışında gözle görülür kontaminasyon
Genel mikrobiyoloji laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir. Özel bir öneriye gerek yoktur.
7.1.3. Gevşek kapaklar
Genel mikrobiyoloji laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir. Özel bir öneriye gerek yoktur.
7.2. Lekeler ve Bertararaf
7.2.1. Gram lekesi
Gram boyası mantar için optimum leke değildir, ancak özellikle maya için kullanılıyorsa, mikoloji için bakteriyoloji/klinik mikrobiyoloji için geçerli olan aynı kılavuzlar takip edilir.
7.2.2. Mikoloji lekeleri
- Calcoflor white tehlikeli madde olarak kabul edilmez; özel bir güvenlik önlemi gerekmemektedir. Rutin laboratuvar prosedürlerini kullanın: yani cilt temasından sonra sabun ve suyla yıkayın; göz temasından sonra gözü suyla iyice durulayın; inhalasyon veya yutmadan sonra hastalık bildirilirse tıbbi yardım alın.
- Slaytların taşınması ve atılması için bulaşıcı materyallere uygulanan kabul edilmiş laboratuvar prosedürlerini takip edin. Kalkoflor beyazı ile boyanmış mantar hücreleri canlı kalabilir.
- Kalkoflor beyazı ile potasyum hidroksit (KOH) kullanılıyorsa, daha sıkı önlemler alınmalıdır. Kılavuz için malzeme güvenlik bilgi sayfasına bakın (103).
— KOH %10–15 çözelti aşındırıcıdır. Dikkatli bir idare edin. KOH ciltte, gözlerde ve solunum yollarında yanıklara veya tahrişe neden olabilir. Göz/cilt temasından ve inhalasyondan veya yutmaktan kaçının. Sıçrama veya aerosol oluşumu tehlikesi varsa eldiven ve göz koruması kullanın.
— KOH, Kaynak Koruma ve Geri Kazanım Yasası (RCRA) kapsamında tehlikeli atık olarak listelenmemiştir. Bir slatta kullanılan küçük miktar calcoflor white içeren slamlar ile bertaraf edilebilir. Daha büyük miktarları elden çıkarıyorsanız, bunu federal, eyalet ve yerel gerekliliklere uygun olarak yapın (104–106). - Laktofenol pamuk mavisi (laktofenol anilin mavisi veya Poirrier mavisi)
— Klinik bir laboratuvarda yaygın olarak kullanılan miktarlarda, laktofenol pamuk mavisi asidiktir; cilt, göz ve giysi ile temastan kaçının.
— Dökülürse suyla iyice durulayın.
— Sıvı ile boyanmış mantar slamları için, bulaşıcı materyallerin taşınması ve atılması için kabul edilen laboratuvar prosedürlerini izleyin.
— Daha büyük miktarlar üretilecek veya atılacaksa, ürün daha tehlikeli, yani inhalasyon ve ciltle temas yoluyla ve özellikle yutulmuşsa toksik olarak kabul edilir. Sadece yeterli havalandırma ile kullanın.
— Federal, eyalet ve yerel düzenlemelere uygun olarak tehlikeli atık olarak atın (107–109). - Hindistan mürekkebi
— Normal kullanım koşulları altında özel bir kişisel koruma gerekmez; ancak maya hücreleri canlı kalabilir.
— Hindistan mürekkebi düzenlenmiş tehlikeli bir atık değildir. Yürürlükteki federal, eyalet ve yerel düzenlemelere uygun olarak imha edin ve slaytları güvenli bir şekilde atın (110). - Asit-hass leke
Tüberküloz laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir. Özel bir öneriye gerek yoktur. - Gomori metenamin gümüş lekesi
— Bileşenler toksik, aşındırıcı ve zararlıdır; cilt ve gözlerle temastan kaçının.
— Yeterli havalandırma ile kullanın; solunmayın.
— Yürürlükteki federal, eyalet ve yerel düzenlemelere uygun olarak tehlikeli atık olarak bertaraf edin (111). - Giemsa lekesi
— Metanol içeriği nedeniyle Giemsa lekesi inhalasyon, emilim veya yutma ile toksiktir. Koruyucu eldiven ve koruyucu gözlük gerekli değildir ancak tavsiye edilir.
— Federal, eyalet ve yerel düzenlemelere uygun olarak imha edin. Tercih edilen yöntem, onaylanmış bir tesiste yakmadır (112).
7.3. Tezgahta Kültür Okuma (1,113)
- Mikoloji aktiviteleri için ayrı, kapatılabilir bir oda önerilir ancak gerekli değildir.
- İster ayrı bir odada ister açık mikrobiyoloji laboratuvarında belirlenmiş bir alanda olsun, bir BSC'de tüm kültür manipülasyonlarını gerçekleştirin. Tüm küf kolonileri (filamentöz, bulanık, pamuklu) Sınıf II BSC'de ele alınmalıdır. Bu durum bakteriyoloji plakalarında yetişen küfler için de geçerlidir. Daha fazla bilgi için bölüm 7.6'ya bakın.
- Hiphal segmentlerinin, conidia'nın veya sporların kazara açılmasını ve yayılmasını önlemek için petri plakalarını (özellikle küf büyümeye başlarsa) kapatmak için shrink contalar veya bant kullanın.
- Coccidioides immitis şüphesi varsa veya filamentli bir kültür postalanacak veya başka bir şekilde başka bir laboratuvara nakledilecekse asla petri plakaları kullanmayın. Vidalı kapak tüplerinde eğikler kullanın.
— Açmadan önce büyüme için tüm plakaları ve eğimleri gözlemleyin. - Genel olarak, maya benzeri koloniler yetiştiren kültürler bir BSL-2 laboratuvarında açık tezgahta okunabilir; ancak izolatın Cryptococcus neoformans (nemli, mukoid koloniler) veya herhangi bir dimorfik mantar olduğundan şüpheleniliyorsa, onu Sınıf IIA2 BSC'ye taşıyın.
- Kokusu olup olmadığını belirlemek için bir mantar kültürünü asla koklamayın. Bakteriyoloji çalışma istasyonu olsa bile açık tezgahta kalıp içeren plakaları açmayın.
7.4. Kişisel Önlemler
7.4.1. Biyogüvenlik kabini
- Sınıf IIA2 BSC bazı mikoloji çalışmaları için önerilir; yani, tüm kalıplar (bulanık, yünlü, pamuksu, pudralı veya kadifemsi) BSC'de, açık tezgahta asla ele alınmamalıdır.
- Mikoloji için, bakteriyoloji için geçerli olan aynı BSC kılavuzlarını izleyin.
7.4.2. Kişisel koruyucu ekipman
- Genel mikrobiyoloji laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir.
- Dermatofit olma olasılığı olan bir küf kültürünü manipüle ederken eldiven giyin ve saatleri ve bilezikleri çıkarın. Görev tamamlandığında elleri ve bilekleri iyice yıkayın.
7.4.3. Dezenfeksiyon
Genel mikrobiyoloji laboratuvarı için öneriler, mikoloji laboratuvarında kullanım için yeterlidir; bunlar, tezgahların ve telefon, bilgisayar, ekipman ve eller serbest telefonlar gibi öğelerin dezenfeksiyonu için kılavuzları içerir.
7.4.4. Laboratuvar atıklarının dekontaminasyonu ve bertarafı
- Klinik mikrobiyoloji için geçerli olan aynı yönergeleri izleyin.
- Bir otoklav mevcut değilse ve tıbbi atıklar tesis dışında işleniyorsa, Coccidioides spp. içeren plakaları ve tüpleri açın ve atmadan önce gece boyunca tamamen 1:10'luk bir çamaşır suyu çözeltisine batırın.
7.5. Laboratuvarın Temiz ve Kirli Alanları
Genel mikrobiyoloji laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir.
7.6. Seçilmiş Ajanlar ve Patojenik Kalıplar
- Bir BSC'deki tüm kalıp benzeri kolonileri ele alın.
- İzolatın yüksek patojenik bir sistemik mantar olma olasılığını gösterebilecek yapıları tespit etmek için bir slayt kültürü kurmadan önce tüm kültürlenmiş küflerin ıslak bir hazırlığını yapın (113).
- Islak preparatta Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis, C. posadasii, Paracoccidioides brasiliensis, Penicillium marneffei veya Cladophialophora bantiana'yı düşündüren izolatların slayt kültürlerini oluşturmaktan kaçının. İyi hazırlanmış ıslak hazırlıklar ve varsa DNA probları ile bunları tanımlamak için her türlü girişimi yapın (113).
- Laboratuvarda izole edilmiş bir organizma H. capsulatum, B. dermatitidis, Coccidioides spp. veya Paracoccidioides brasiliensis olarak tanımlanırsa, küf-form kültürlerini ve bulaşıcı konidi içermesi muhtemel çevresel örneklerin işlenmesi için BSL-3 uygulamaları ve tesisleri önerilir (1).
- Coccidioides spp. şu anda CDC/ABD'ye kayıt gerektiren seçkin bir ajan olarak sınıflandırılan tek mantarlardır. Sahiplik, kullanım, depolama ve/veya transfer için Tarım Bakanlığı (1,114). Bu gelecekte değişebilir.
- Otoklavlama mevcut olmadığında (yani, kültür plakaları tesis dışı otoklavlama için bir yüklenici tarafından alındığında) Coccidioides izolatlarını dekontamine etmek için, plakaları ve tüpleri gece boyunca, bertaraf edilmeden önce açılmış tüpleri ve plakaları tamamen batıran taze bir 1:10 ağartıcı çözeltisine ıslatın (bkz. Bölüm 3.5.3).
7.7. Kan Kültürü Tezgahı
- Genel mikrobiyoloji laboratuvarı için kılavuzlar mikoloji laboratuvarı için de geçerlidir.
- Küf benzeri koloniler yetiştiren plakalar açık tezgahta değil, bir BSC'de incelenmelidir.
- Küçük hücreli bir maya (~3 µm) tespit edilirse, H. capsulatum olasılığını göz önünde bulundurun ve Sınıf 2 BSC'de (113) BSL-2 koşulları altında işlem alın.
7.8. Enstrümantasyon
Mikoloji çalışmaları için kullanılan aletler en yaygın olarak sürekli izlenen kan kültürü ve maya tanımlama için kullanılanlardır. Bakteriyoloji/klinik mikrobiyoloji için geçerli olan aynı yönergeleri izleyin.
7.9. Hızlı Test (Kitler)
- Mikolojide monomorfik mayalar için klinik mikrobiyoloji kılavuzlarını uygulayın.
- İzolat bir kalıpsa, BSC'de ele alınmalıdır.
7.10. Moleküler Test
Küf izolatlarının nükleik asitlerin ekstraksiyonu sırasında bir BSC'de ele alınması gerektiğine dair ek tavsiye ile birlikte mikoloji için klinik mikrobiyoloji güvenlik kılavuzlarını takip edin.
8. Viroloji Laboratuvarı
8.1. Numune İşleme ve Oturum Açma Tezgahı
8.1.1. Numune alma ve oturum açma ile ilişkili biyotehlikeler
Klinik viroloji laboratuvarı, virüs tespiti için çok çeşitli klinik örnekler alır. Bu materyalin bulaşıcı doğası büyük ölçüde bilinmediğinden, personel, çevre ve diğer klinik örneklerin kontaminasyonunu önlemek için özel dikkat gösterilmelidir.
- Tüm klinik örnekleri biyogüvenlik seviyesi (BSL)-2 koşulları altında tutun (1). Bazı özel patojenler ve seçkin ajanlar daha katı biyogüvenlik koşulları altında ele alınmalıdır.
- Klinik örnekler her işlendiğinde bir laboratuvar önlüğü, eldiven ve göz koruması giyin. Bu, numune alma ve oturum açma işlemlerini içerir.
- Kültür düzenini ve diğer tüm örnek manipülasyonlarını Sınıf II veya daha yüksek bir biyolojik güvenlik kabininde (BSC) gerçekleştirin.
- Açılmayacak veya işlenmeyecek şüpheli ajanların (örneğin, çiçek hastalığı, Ebola virüsü, veziküler stomatit virüsü, şap ve ağız virüsü, domuz vebası virüsleri, CDC seçilmiş ajanlar) adlarını içeren bir "İşlemeyin/Test Etmeyin" listesi derleyin. Test için alınan bu tür numunelerin derhal ve uygun şekilde paketlenmesi ve uygun bir referans laboratuvarına gönderilmesi gerekir. Herhangi bir yönlendirmeden önce uygun referans laboratuvarına başvurun.
- Laboratuvarda bir BSL-3 tesisi varsa, BSL-3 koşulları altında işlenmesi ve test edilmesi gereken şüpheli ajanların bir listesini derleyin.
8.1.2. Sızıntılı kaplar
- Sızdıran kapları işlemeyin, çünkü bunlar teknoloji uzmanı için bir tehlike oluşturabilir, laboratuvarı kirletebilir veya yanlış bir sonuç üretebilecek numunenin gelmesi ve/veya kontaminasyon için bir fırsat sunabilir.
- Testin neden yapılmayacağı konusunda ilgili doktora veya başvuruda bulunan veterinere veya kuruluşa bilgi verin ve yeni bir numune talep edin.
- Sızdıran numune kaplarını bir biyolojik tehlike torbasına koyun ve otoklavlama veya başka bir onaylanmış yöntemle dekontamine edin.
8.1.3. Konteyner dışında gözle görülür kontaminasyon
Kabın dışında az miktarda kontaminasyon (örn. kurutulmuş bir kan lekesi) olan numuneler laboratuvar müdürünün dikkatine sunulmalıdır. Müdür numuneyi inceleyebilir ve test için uygun olup olmadığını ve laboratuvar personeli için tehlike oluşturup oluşturmadığını belirleyebilir.
8.1.4. Şüpheli örnekler için özel önlemler
- İcra yetkilileri tarafından yerel ve eyalet düzenlemelerine uygun olarak ve chain-of-custody prosedürlerini takip ederek laboratuvara taşınan örnekleri kabul edin. Ancak teste başlamadan önce testin amacının ve şüpheli ajanın belirlenmesi gerekir. Numune işlenmese bile gözetim zinciri için uygun prosedürlerin yürürlükte olduğundan ve takip edildiğinden emin olun.
- Numune girişi ve işleme personeli, numune test için gönderilmeden önce şüpheli ajan "İşlemeyin/Test Etmeyin" listesini kontrol etmekten sorumludur (bkz. 8.1.1). Şüpheli ajan listedeyse laboratuvar müdürüne bildirin.
- Laboratuvarda bir BSL-3 tesisi varsa, numune işleme ve oturum açma personeline yalnızca BSL-3 laboratuvarında ele alınması gereken testlerin ve şüpheli ajanların bir listesini sağlayın.
- Laboratuvara katılım standart işletim prosedürlerinde açıklandığı gibi onaylanmamış veya olağandışı numune tiplerini işlemeyin veya test etmeyin.
- Laboratuvarın test sertifikasına sahip olmadığı hiçbir numuneyi kabul etmeyin.
8.2. Lekeler, Kimyasallar ve Bertaraf
- Viroloji ve elektron mikroskobu laboratuvarındaki kimyasal tehlikeler, laboratuvar tarafından sağlanan hizmetin kapsamına bağlı olarak değişecektir. Bu bölümde sunulan potansiyel tehlikelerin, kullanılan tüm kimyasalları kapsamayan ve doğası gereği eğitici olması amaçlanmıştır ve malzeme güvenlik bilgi formu (MSDS) bilgilerinin veya eyalet, yerel veya kurumsal politikaların yerini alması amaçlanmamıştır.
- Laboratuvarda kullanılan kimyasal davlumbaz yıllık olarak sertifikalandırılmalı ve uygun çalışma spesifikasyonları için günlük olarak kontrol edilmelidir.
8.2.1. Alkoller
Etanol, metanol, izopropil alkol ve alkol karışımları viroloji laboratuvarında hücreleri sabitlemek, nükleik asit ekstraksiyonu ve çökeltme için ve dezenfektan olarak kullanılır.
- Konsantre alkolleri yanıcı depolama için derecelendirilmiş bir kabinde saklayın. İzopropil ve metanol alkol buharları toksik olabilir. Bu ürünleri sadece iyi havalandırılan alanlarda kullanın. İzopropil alkol de kontakt dermatite neden olabilir. Alkoller, zarflı virüsler için etkili dezenfektanlardır, ancak zarfsız virüsler üzerinde çok az etkisi vardır.
- Alkolleri kapalı alanlarda kullanmayın. Çözücü dumanlarına maruz kalmak göz, burun ve boğaz tahrişine, uyuşukluğa, baş ağrısına ve cilt kuruluğuna neden olabilir. Mümkün olduğunda, bunları bir davlumbazda kullanın.
- Açık alevlerin etrafında alkol veya kıvılcımlara neden olan aletler kullanmayın.
- Cilde maruz kalmayı en aza indirmek için alkolleri kullanırken lateks, vinil veya nitril eldiven giyin.
- Bazı alkoller plastikleri bulanıklaştırır; plastik alet yüzlerini alkollerle silerken dikkatli olunmalıdır.
8.2.2. Antibiyotikler
Rutin kullanımda antibiyotikler arasında penisilin, streptomisin, gentamisin, siprofloksasin, kanamisin, tetrasiklin, amfoterisin B ve neomisin bulunur. Bu antibiyotikler kültür ortamında ve viral taşıma ortamlarında bulunabilir.
Çok sayıda bakteri veya mantar içeren numunelerde antibiyotik konsantrasyonlarını arttırmak için konsantre antibiyotik karışımları sıklıkla kullanılır. Konsantre antibiyotik çözeltileri çalışma konsantrasyonunun 50 katı (50×) ve 100 kat (100×) olarak satın alınabilir.
Viroloji laboratuvarında antibiyotik hazırlama ve kullanımı ile ilişkili riskler nispeten düşük olsa da, hastane, ilaç ve hayvan işçilerinde antibiyotik hazırlama ve kullanımı aşırı duyarlılık reaksiyonları ve kontakt dermatitus (115,116) ve astım (116-120) ile ilişkilendirilmiştir.
- Antibiyotik tozlarını kullanırken ve konsantre antibiyotik çözeltileri hazırlarken veya dağıtırken daima eldiven, maske ve göz koruması kullanın. Bazı durumlarda solunum koruması (örneğin, davlumbaz, maske veya pozitif basınçlı solunum cihazı) gerekli olabilir.
- Antibiyotik tozları ve çözeltileri ile çalışırken aerosol oluşumunu önleyin çünkü bu aerosoller çevreyi kirletebilir, diğer laboratuvar çalışanlarını duyarlı hale getirebilir (115) ve antibiyotiğe duyarlı bireyler için tehlike oluşturabilir (115,116).
- Bilinen antibiyotik hassasiyetleri olan laboratuvar personelinin konsantre antibiyotik solüsyonları hazırlamasına izin vermeyin.
- Antibiyotiklerin gelişmekte olan fetüs üzerinde olumsuz veya bilinmeyen etkileri olabileceğinden, hamile çalışanları konsantre antibiyotik çözeltileri hazırlamaktan dışlamak da ihtiyatlı olabilir.
8.2.3. Ağartma çözeltileri (bkz. 3.4.2)
8.2.4. Sikloheksimid
Sikloheksimid bir antibiyotik, protein sentezi inhibitörü ve bitki büyüme düzenleyicisi olarak kullanılır. Viroloji laboratuvarında, Chlamydia yeniden besleme ortamlarında sikloheksimid kullanılmaktadır.
- Sikloheksimid tozları ve çözeltileri tahriş edicidir, kızarıklığa, kaşıntıya ve yanmaya neden olur. Hayvan çalışmaları, sikloheksimidin doğum kusurları, sperm toksisitesi ve testis hasarı dahil olmak üzere olumsuz üreme etkilerine neden olduğunu göstermiştir. Sikloheksimidin insanlarda benzer üreme etkilerine neden olup olmadığı bilinmemektedir, bu nedenle üreme toksini gibi ele alın. Daha fazla bilgi için MSDS belgelerine bakın.
- Laboratuvarda en yüksek maruz kalma potansiyeli sikloheksimid tozlarının tartılması ve sikloheksimid çözeltilerinin hazırlanması sırasındadır. Sikloheksimid vücuda aerosol olarak ve oral olarak toza maruz kalma yoluyla girebilir. Maruz kalma, yiyecek, içecek veya kozmetiklerin elle kontaminasyonu yoluyla veya doğrudan kontamine ellerle ağza dokunarak da gerçekleşebilir.
- Sikloheksimid tozunu kimyasal bir davlumbazda tutun.
- Cilt kontaminasyonunu, cilt emilimini ve/veya elle ağıza maruz kalmayı önlemek için sikloheksimid tozlarını ve çözeltilerini kullanırken laboratuvar önlüğü ve eldivenleri de dahil olmak üzere kişisel koruyucu ekipman (PPE) giyin. Eldiven çıkarıldıktan sonra ellerinizi sabun ve suyla yıkayın.
- Sikloheksimid bertarafı
Sikloheksimid alkali çözeltiler (pH >7.0) ile inaktive edilir. Aspire eden sikloheksimid içeren kültür sıvılarını 1:10 ağartıcı çözeltisi içeren vakum tuzaklarına satmak kimyasalı etkisiz hale getirecektir. Çoğu sabun ve deterjan alkalidir ve bu ajanlar ayrıca sikloheksimidi inaktive eder.
8.2.5. Dimetil sülfoksit
Dimetil sülfoksit (DMSO) hücre kültürlerini dondururken kriyoprotektant olarak kullanılır. DMSO güçlü bir çözücüdür ve cilde ve lateks eldivenlere nüfuz edebilir.
- Cilt ve mukoza zarları ile teması en aza indirin.
- DMSO çözeltilerini kullanırken laboratuvar önlüğü ve göz koruması giyin. Çift eldiven ihtiyatlı olabilir çünkü kimyasal sonunda lateks eldivenlere nüfuz eder.
- Kimyasal laboratuvarlarda yaygın olarak kullanılan nitril eldivenler DMSO ile hızla çözülür.
- DMSO cilde kolayca nüfuz eder ve DMSO'da çözünen maddeler hızla emilebilir. Bu özellik, antifungal ilaçların cilde, ayak tırnaklarına ve tırnaklara nüfuz etmesine izin vermek için bir ilaç verme sistemi olarak kullanılmıştır. Ancak laboratuvarda, DMSO maruziyeti kirleticilerin emilimini kolaylaştırabilir. DMSO ciltle temas ettiğinde, bazı insanlar istiridye veya sarımsak benzeri bir lezzeti hızlı bir şekilde tadabileceklerini bildiriyor.
- DMSO, memeli somatik hücreleri, bakterileri ve mayası için mutajeniktir. Uzun süreli maruz kalma kan, böbrek, karaciğer, cilt, mukoza ve gözlerde hasara neden olabilir. Daha fazla bilgi için MSDS belgelerine bakın.
8.2.6. Elektron mikroskobu lekeleri, fiksatifler ve tamponlar
- Elektron mikroskobu fiksatifleri olarak osmiyum tetroksit ve glutaraldehit kullanılır. Sıvı ve buhar bileşenleri güçlü fiksatiflerdir ve laboratuvar personelinin cilt, mukoza ve göz dokularını hızla düzeltir.
— Kimyasal davlumbazdaki şişeleri açın. Flakonları çift şişede saklayın ve üstleri parafilm ile kapatın.
— Flakonları tek kullanımlık eldivenlerle tutun.
— Fiksatifi tutarken ve dokuları sabitlerken göz koruması, eldiven ve tek kullanımlık laboratuvar kaplamaları kullanın. - Elektron mikroskobu laboratuvarında negatif lekeler olarak uranil asetat, fosfotungstik asit ve amonyum molibdat kullanılmaktadır. Bu bileşiklerin tümü ağır metaller içerir ve solunur, yutulur veya kesikler veya sıyrıklar yoluyla verilirse çok toksiktir. Uranil asetat zayıf radyoaktiftir ve tozların metal bir kapta tutulması gerekir. Fosfotungstik asit aşındırıcıdır ve açıkta kalan cilt ve mukoza zarlarında yanıklara neden olur. Amonyum molibdat göz teması, yutma ve inhalasyon durumunda çok tehlikelidir.
— Laboratuvar çalışanları, tozları ve çözeltileri işlerken laboratuvar önlüğü, eldivenler ve göz koruması dahil olmak üzere KKD kullanmalıdır. Daha fazla bilgi için MSDS belgelerine bakın.
— Solunmasını önlemek için bu lekeleri kimyasal bir davlumbazda hazırlayın.
— Çalışma alanlarının tozlarla kirlenmesini önlemek için özen gösterilmelidir. - Sodyum kakodilat ve veronal asetat gibi elektron mikroskopi tamponları sırasıyla arsenik ve sodyum barbital içerir. Bu tamponlar dikkatli bir şekilde ele alınmalıdır.
— Tozların solunmasını önlemek için kimyasal bir davlumbazda tamponlar hazırlayın.
— Tozları ve çözeltileri kullanırken laboratuvar önlüğü, eldiven ve göz koruması dahil KKD kullanın. Daha fazla bilgi için MSDS belgelerine bakın.
8.2.7. Elektron mikroskobu gömme ortamı
(Met) akrilatlar ve epoksi bazlı materyaller, elektron mikroskobu için biyolojik örnekleri gömmek için sıklıkla kullanılır. Epoksi ürünler arasında Epon, Araldite, Spurr reçinesi ve Maraglas bulunur. Formvar (polivinil formal), elektron mikroskobu ızgaraları ve kopyalar yapmak için bir destek filmi olarak kullanılır. Bu bileşiklerin birçoğu toksik, kanserojen veya potansiyel olarak kanserojendir ve cilt tahrişine, dermatite ve cilt hassasiyetine neden olduğu bilinmektedir. Daha fazla bilgi için bireysel MSDS belgelerine bakın.
- Bu bileşikleri iyi havalandırılan alanlarda, tercihen kimyasal bir davlumbazda kullanın. Bu kimyasalların birçoğu yanıcı çözücülerde çözülür, ısı ve tutuşma kaynaklarından uzak tutulmaları gerekir.
- Plastik monomerler lateks ve vinil eldivenlere hızla nüfuz edecektir; plastiklerle gömerken bu eldivenleri sık sık değiştirin (121–124).
- Plastik gömülü blokları tutarken veya kırparken eldiven giyin. Tüm monomerler polimerize olmayabilir ve polimerize edilmemiş monomerler toksik özelliklerini koruyacaktır.
- Çalışma alanlarını kağıt havlu veya plastik kaplı emici pedlerle örtün ve dökülenleri hemen alkolle temizleyin.
- Ciltle temas eden reçineleri çıkarmak için sabun ve su kullanın. Reçineleri ciltten uzaklaştırmak için alkol kullanmayın çünkü alkol reçinenin penetrasyonunu artırır.
- Gemme medyası ve film yapım çözümlerinin elden çıkması. Gömme malzemeleri polimerleştirildiğinde veya sertleştirildiğinde genellikle daha az tehlikelidir.
— Asla plastik içeren çözeltileri (örn. propilen oksit–Epon karışımı) drenaja dökmeyin. Kanalizasyonda sertleşecekler ve fişe takabilirler.
— Bertaraf etmeden önce tüm atıkları sertleştirin. Sertleştirilmiş atıkları bir davlumbazda saklayın ve kabı tehlikeli atık olarak atın.
— Atılan kapları, beherleri, flakonları, pipetleri ve reçinelerle veya destek filmleriyle temas eden tüm aletleri, tehlikeli atık olarak gönderilene kadar davlumbazdaki delinmeye dayanıklı kaplarda saklayın.
8.2.8. Ethidyum bromür
Ethidium bromür (EtBr), elektroforez ve diğer jel bazlı ayrımlarda nükleik asit bantlarını görselleştirmek için radyoaktif olmayan bir belirteç olarak yaygın olarak kullanılan bir DNA interkalasyon ajanıdır. EtBr, akut maruziyetten sonra toksik olan güçlü bir mutajendir ve cilt, gözler, ağız ve üst solunum yolu için tahriş edicidir.
- Saf EtBr'yi kimyasal bir davlumbazda tutun çünkü toz tüm laboratuvarı kolayca kirletebilir.
- EtBr çalışmasının gerçekleştirileceği bir alan belirleyin ve EtBr çözümlerini yalnızca o alanda kullanın.
- Belirlenen alan içindeki yüzeyleri plastik kaplı emici bir ped ile örtün. Pedi planlı olarak veya kontamine olduğunda değiştirin.
- EtBr çözeltilerini ve jellerini tutarken laboratuvar önlüğü, göz koruması ve eldiven dahil KKD kullanın.
Not: Lateks eldivenler EtBr'ye karşı çok az koruma sağlar. Nitril eldivenler etkili bir kısa vadeli bariyer sağlar. Çift eldiven daha fazla koruma sağlar. - Eldivenleri çıkardıktan sonra ellerinizi iyice yıkayın.
- Sodyum hipoklorit çözeltilerinin kullanılmış EtBr çözeltilerine uygulanması, etidyum bromürü etkisiz hale getirecektir, ancak Ames testine göre reaksiyon ürünleri mutajeniktir (125). Bu harcanan çözümleri bertaraf etmek için alternatif bir deaktivasyon yöntemi, kullanım veya izin verilen bir tehlikeli atık arıtma tesisi kullanın.
- EtBr kullanımının olduğu çalışma alanlarında sodyum hipoklorit çözeltilerinin kullanılması da önerilmemektedir.
- EtBr atık yönetimi
— Küçük hacimli veya konsantrasyonlarda EtBr atıklarını bile tehlikeli atık olarak toplayın ve yönetin veya yerel düzenlemelere uyun.
— EtBr ile temas eden torba malzemeleri ve tehlikeli kimyasal atık olarak bertaraf edin.
— Aktif kömür ekleyerek EtBr çözelti hacimlerini en aza indirin. Kömür filtrasyonla toplanabilir ve tehlikeli atık bertarafı için sızdırmaz kaplara yerleştirilebilir.
— EtBr içeren agaroz jellerini sızdırmaz plastik bir kaba koyun ve tehlikeli atık olarak atın.
8.2.9. Evans mavisi
Evans mavisi, floresans mikroskobu sırasında karşı leke olarak kullanılır. Evans mavi tozları ve çözeltileri cildi tahriş edicidir, ancak bu bileşikle ilişkili bilinen bir yanıcılık, kanserojenlik veya teratojenisite uyarısı yoktur.
- Laboratuvarda en yüksek maruz kalma potansiyeli, Evans mavi tozlarının tartılması ve çözeltilerin hazırlanması sırasındadır. Solunum tozları solunum tahrişine neden olabilir. Cilt ve mukoza zarı tahrişi de oluşabilir.
- Solunmasını önlemek için Evans mavi tozunu kimyasal bir davlumbazda tutun.
- Evans mavi tozlarını ve cilt kontaminasyonunu önlemek için çözümleri kullanırken laboratuvar önlüğü, göz koruması ve eldivenler dahil olmak üzere KKD giyin.
8.2.10. Guanidinyum çözeltileri
Guanidinyum klorür, guanidinyum tiyosiyanat ve guanidinyum izotiyosiyanat, nükleik asit ekstraksiyon prosedürleri sırasında hücreleri ve proteinleri (özellikle RNaslar ve DNazlar) denatüre etmek için kullanılan kaotropik ajanlardır.
Bu kimyasallar güçlü tahriş edici maddelerdir ve göze maruz kalma kızarıklık, tahriş ve ağrıya neden olabilir. Yutulurlarsa toksiktirler ve nörolojik rahatsızlıklara neden olabilirler. Solunursa, guanidinyum bileşikleri solunum yolu tahrişi öksürüğüne ve nefes darlığına neden olabilir.
- Solunmasını önlemek için guanidinyum tozlarını kimyasal bir davlumbazda tutun.
- Tozları ve çözeltileri teslim ederken laboratuvar önlüğü, eldivenler ve göz koruması da dahil olmak üzere KKD giyin.
- Toksik duman üretimi nedeniyle guanidinyum tiyosiyanat içeren numune atığına çamaşır suyu eklemeyin. Guanidinyum bileşikleri asitler ve diğer oksitleyicilerle reaktiftir ve siyanür buharları (tiyosiyanat ve izotiyosiyanat türevleri), hidroklorik asit buharları (guanidinyum hidroklorür) ve azot oksitler (tüm formlar) dahil olmak üzere toksik dumanlar üretir.
8.2.11. Nötr kırmızı
Nötr kırmızı, bazı plak deneylerinde kullanılan bir pH göstergesi ve hayati bir lekedir. Yutulması, solunması veya cilt yoluyla emilmesi zararlı olabilir ve ciltte, gözlerde ve solunum yollarında tahrişe neden olabilir.
- Solunmayı önlemek için nötr kırmızı tozu kimyasal bir davlumbazda tutun.
- Nötr kırmızı tozları ve cilt kontaminasyonunu önlemek için çözeltileri kullanırken laboratuvar önlüğü ve eldivenleri de dahil olmak üzere KKD giyin.
- Laboratuvarda en yüksek maruz kalma potansiyeli nötr kırmızı tozların tartılması ve çözeltilerin hazırlanması sırasındadır.
8.2.12. Merthiolat (thimerosal)
Merthiolat veya thimerosal, bazı laboratuvar çözeltilerinde koruyucu olarak kullanılan cıva içeren bir antiseptik ve antifungal ajandır. Konsantre thimerosal, solunduğunda, yutulduğunda ve ciltle temas ettiğinde çok toksiktir.
- Cilt ve mukoza zarına maruz kalmayı önlemek için mertiolat tozları ve çözeltileri kullanırken laboratuvar önlüğü ve eldivenleri de dahil olmak üzere KKD giyin.
- Bazı ticari reaktiflerde kullanılan düşük miktarlar nispeten güvenlidir, ancak thimerosal maruziyet kümülatif etkilere sahip olabilir. Vücutta, mertiyolat metabolize edilir veya etilcıva (CHHg+) ve tiyosalisilata bozunur. Etilcıva, yaklaşık 18 günlük bir yarı zaman ile kandan ve yaklaşık 14 gün içinde beyinden temizlenir.
8.2.13. Organik çözücüler
- Aseton, viroloji laboratuvarında kullanılan başlıca organik çözücüdür ve öncelikle hücre smearları için fiksatif olarak kullanılır.
- Aseton yanıcıdır ve tahriş edici olarak sınıflandırılır, göz hasarına ve cilt ve solunum yolu tahrişine neden olur. Uzun süreli maruz kalma üreme, sinir sistemi, böbrek, karaciğer ve cilt hasarına neden olabilir.
- Asetonları yanıcı bir saklama dolabında saklayın ve ısı, kıvılcım veya alev kaynaklarından uzak tutun. Asetonu patlamaya dayanıklı olarak derecelendirilmemiş bir buzdolabında saklamayın veya kullanmayın. Soğutma pompasından ve kapıyla çalıştırılan ışık anahtarından gelen kıvılcımlar aseton dumanlarını ateşleyebilir ve patlamaya neden olabilir.
- Solunum tahrişini önlemek için iyi havalandırılan bir alanda (veya kimyasal davlumbazda) aseton kullanın.
- Vinil eldivenler asetonları ve diğer agresif organik çözücüleri işlemek için vinil muayene eldivenleri kullanmayın çünkü vinil eldivenler bu ajanlar tarafından çözülebilir.
- Lateks eldivenler sonunda asetonda çözülür ve kısa süreli aseton kullanımı için çift eldiven önerilir.
- Asetonlar birçok plastiği çözecek veya bulutlayacaktır ve plastik cihazları aseton maruziyetinden korumaya özen gösterilmelidir.
- Elektron mikroskobu
— Elektron mikroskobu laboratuvarında etan, propilen oksit ve eterler dahil olmak üzere birçok uçucu çözücü kullanılmaktadır. Bu çözücüler son derece yanıcıdır ve yangın ve patlama tehlikeleridir. Kimyasalları tutuşturabilecek statik deşarjların önlenmesine özen gösterilmelidir.
— Solunum tahrişini önlemek ve patlayıcı buharların birikmesini en aza indirmek için bu çözücüleri kimyasal bir davlumbazda kullanın.
— Bu kimyasalları tutarken laboratuvar önlüğü, göz koruması ve kimyasal olarak dayanıklı eldivenler de dahil olmak üzere KKD giyin.
— Açık alev kullanımını caydırmak için yanıcı gaz hatlarını elektron mikroskobu laboratuvarlarına kesmek ihtiyatlı olabilir.
— İyi havalandırılan yanıcı bir saklama dolabında küçük miktarlarda saklayın ve bu reaktifleri ısı, kıvılcım veya alev kaynaklarından uzak tutun.
8.2.14. Sodyum azid
Sodyum azid, monoklonal antikorlar, tamponlar ve enzim immünoassay reaktifleri dahil olmak üzere birçok laboratuvar reaktifinde yaygın bir koruyucudur.
- Sodyum azid bir akut toksin ve bir mutajendir. Bu madde ile tüm teması mümkün olan en düşük seviyeye düşürün.
- Sodyum azid ve hidrazoik asidin (sudaki NaN'den oluşan HN) laboratuvar hayvanlarında ve insanlarda hipotansiyon (düşük tansiyon) ürettiği ve hemoglobin ile güçlü kompleksler oluşturduğu ve böylece kanda oksijen taşınmasını engellediği bilinmektedir.
- Sodyum azid içeren çözeltileri kullanırken eldiven, laboratuvar önlüğü ve göz koruması dahil KKD kullanın.
- Sodyum azit, ayrışma sıcaklığının (300°C) yakınında ısıtılması veya metallerle birleştirilmesi dışında patlayıcı değildir.
- Katı veya konsantre sodyum azid çözeltilerini asla drenajda yıkamayın, çünkü bu uygulama azid drenaj hatlarında kurşun veya bakır ile reaksiyona girdiğinde ve patladığında ciddi olaylara neden olabilir.
- Çoğu laboratuvar reaktifinde bulunan seyreltik çözeltiler (%0,1), metal azid birikmesini önlemek için lavabodan bol miktarda su ile yıkanabilir. Sodyum azit, ağır metaller (gümüş, altın, kurşun, bakır, pirinç veya sıhhi tesisat sistemlerinde lehim gibi) ve metal tuzları ile reaksiyona girerek kurşun azid ve bakır azid gibi oldukça patlayıcı bileşikler oluşturur. Bu metal azidler, sıhhi tesisat tamir edildiğinde veya sarsıldığında patlayabilir.
- Sodyum azidin sağlam cilde kolayca nüfuz etme yeteneği nedeniyle İş Güvenliği ve Sağlığı İdaresi (OSHA) İzin Verilen Maruz Kalma Sınırlarına bir "cilt" tanımı verilmiştir. Herhangi bir dermal maruziyet, sodyum azide genel maruz kalmaya önemli ölçüde katkıda bulunabilir.
- Sodyum azid uyumlu değildir ve kromil klorür, hidrazin, brom, karbon disülfit, dimetil sülfat, dibromomalonitril, güçlü asitler (hidroklorik, sülfürik ve nitrik gibi) ve asit klorürler ile şiddetli reaksiyona girebilir.
8.3. Hücre Kültürlerini Tezgahta Ele Almak
- Klinik örneklerle aşılanmış olsun ya da olmasın, tüm hücre kültürleri potansiyel olarak bulaşıcıdır. Birçok hücre hattında, diploid hücrede ve birincil kültürde istenmeyen veya maceracı viral ajanlar bulunmuştur (Tablo 9). Rasteracı ajanlar hücre kültürü manipülasyonları sırasında yayılabilir ve
- son veya sürekli olarak enfekte olmuş birincil doku, ikincil kültürler ve hücre hatları;
— fetal buzağı serumu ve tripsin gibi hayvansal ürünler; veya
— hücreleri ölümsüzleştirmek için kullanılan dönüştürücü ajanlar (insan papilloma virüsü [HPV], SV-40, herpesvirüsler, retrovirüsler, adenovirüsler ve diğerleri). - Bu ajanların çoğu, sitopatik etkiler üretmedikleri için tespit edilmeden gidebilir; bu nedenle, hücre geçişi ve arşivleme bu ajanları nesiller boyunca sürdürebilir.
8.3.1. Hücre hatları
- İnsan (ve potansiyel olarak hayvan) doku, hücre ve kanın birincil kültürleri, insanları enfekte edebilecek istenmeyen veya maceracı bulaşıcı ajanları barındırmak için en büyük riski sunar. Sonuç olarak, OSHA, Kanla Bulaşan Patojenler Üzerine Son Kuralına insan hücre hatlarını dahil etti (33). OSHA Standartları CFR 29, Kan Yoluyla Bulaşan Patojenler, insan kanı ve dokusuna atıfta bulunsa da, veteriner laboratuvarında bu standartlara uyulması tavsiye edilir. Sınıf II BSC'de doku kültürü prosedürlerini yürütün.
- Primat hücreleri ve dokuları da laboratuvar çalışanları için risk oluşturmaktadır. SV-5 ve SV-40, birincil rhesus maymun böbrek hücrelerinin yaygın kirleticileridir ve makaklardan ve diğer Eski Dünya maymunlarından gelen kültürler, Herpesvirüs simiae (B-virüsü) ile yakında enfekte olabilir. B-virüs enfeksiyonu, bu hayvanları ve dokularını idare eden personel için genellikle ölümcül bir tehlike teşkil eder.
- Çıplak ve ciddi kombine bağışıklık eksikliği (SCID) farelerinden gelen kültürler, laboratuvarlarda subklinik veya kronik enfeksiyonlara neden olabilecek ajanları barındırma konusunda özel bir risk oluşturmaktadır.
- Bazı hücre hatları SV-40, Epstein-Barr virüsü, adenovirüs veya HPV gibi viral ajanlarla ölümsüzleştirildi. Bu hücreler bulaşıcı virüs üretebilir veya hücreler içinde viral genomik materyale sahip olabilirler. Diğer hücre hatları, deneyler sırasında bilerek veya kültür manipülasyonu sırasında yanlışlıkla tanıtılan viral genetik elementleri taşıyabilir. Bu virüsler ve virüs genetik elementleri donmaya karşı hayatta kalır ve arşivlenmiş kültür materyallerinde bulunabilir. Birçok hücre hattı, laboratuvar çalışanları için enfeksiyon tehlikesi oluşturabilecek geniş konak menzilli retrovirüslerle sürekli olarak enfekte olur.
- Tümörojenik insan hücreleri kendi kendine aşılamadan (126-129) potansiyel bir tehlike oluşturabilir. Çıplak farelere inoküle edilmiş tümörler veya tümör hücreleri, lenfositik koryomenenjit virüsü (LCMV) gibi ek maceralı ajanlar edinebilir.
- Maceracı virüslerin çoğu sitopatik etkiler üretmez veya hücre fenotipini değiştirmez ve birçoğu uzun süre sıvı azotta donma ve depolamada hayatta kalabilir.
- Enfekte tümör hücreleri kültürlendiğinde, süpernatant sıvılar bulaşıcı virüs içerebilir ve laboratuvar isteğe bağlı olarak bunu biyolojik olarak tehlikeli atık olarak tedavi etmeyi seçebilir. LCMV, hamile kadınlar için özel bir sorun teşkil eder çünkü virüs fetüse bulaşabilir, fetal ölüme veya şiddetli merkezi sinir sistemi malformasyonuna neden olur.
8.3.2. Hücre kültürü uygulamaları
İnsan veya hayvan hücrelerini ve dokularını idare eden veya manipüle eden işçiler, bu hücre ve dokularda bulunabilecek potansiyel olarak bulaşıcı gizli ve tesadüfi ajanlara olası maruz kalma riski altındadır. CDC/Ulusal Sağlık Enstitüleri tarafından önerilen hücre kültürü uygulamaları (1) aşağıdakileri içerir.
- Laboratuvar önlükleri, eldivenler ve göz koruması gibi KKD için BSL-2 tavsiyelerine kesinlikle uyun.
- BSL-2 uygulamalarını ve muhafazasını kullanarak insan ve diğer primat hücrelerini kullanın.
- Tüm işleri Sınıf II veya daha yüksek bir BSC'de gerçekleştirin. Sınıf I güvenlik dolapları ve temiz banklar, operatör için yeterli koruma sağlamadıkları için asla hücre kültürü manipülasyonu için kullanılmaz.
- Atmadan önce hücre kültürleriyle temas eden tüm materyalleri otoklavlayın veya dezenfekte edin.
- İnsan hücreleri ve dokuları ile çalışan tüm laboratuvar personelini, kan yoluyla bulaşan patojenlere özgü bir meslek hekimliği programına kaydedin ve kurumun maruz kalma kontrol planı tarafından belirlenen politika ve kılavuzlar kapsamında çalışın.
- İnsan hücreleri ve dokuları ile çalışan laboratuvar personelinin bir temel serum örneği sağlaması gerekip gerekmediğini belirleyin (bu bir risk değerlendirmesine dayalı kurumsal bir politika ise), hepatit B bağışıklaması önerilebilir ve bir maruz kalma olayının ardından bir sağlık uzmanı tarafından değerlendirilir (1). İnsan olmayan primat kanı, vücut sıvıları ve diğer dokularla çalışan kişiler için benzer programlar önerilir.
8.3.3. Hücre kültürü okumasıyla ilişkili biyolojik tehlikeler
- Kültür tüplerinin dudağındaki kurutulmuş madde, kontaminasyon tehlikesi oluşturabilir. Tüm kültür kaplarını kontamine olmuş gibi tutun.
— Viral kültürleri ele alırken eldiven ve laboratuvar önlüğü giyin.
— Potansiyel bir sıçrama tehlikesi varsa göz koruması kullanın.
— Bir BSC'de tüm kültür manipülasyonlarını gerçekleştirin.
— Etkili bir yöntem (genellikle otoklavlama veya kimyasal dezenfeksiyon) kullanarak atılmadan önce kültür tüplerini ve hücre kültürleriyle temas eden diğer malzemeleri dekontamine edin (1). - Kabuk flakon, tüp ve diğer kültürler, aerosol üretebilen çoklu manipülasyonlardan (örneğin, medya aspirasyonu, yeniden besleme, aşılama) geçer. Bu aerosoller ve manipülasyonlar kültür kabının dışını kirletebilir.
- Başka bir raftaki ara sıra sızdıran tüp, alt raflardaki gemilerin dışını da kirletebilir ve kontaminasyona dair görünür kanıt bırakmayabilir.
8.3.4. Sıvı azot kullanımıyla ilişkili biyolojik tehlikeler
Sıvı azot, dewar'da ampuller kırıldığında kirlenebilir ve kirleticiler azotta korunabilir (23). Bu potansiyel olarak bulaşıcı kirleticiler, dewar'daki diğer şişeleri kirletebilir ve sıvı azot buharlaştıkça bulaşıcı bir aerosol oluşturabilir. Sıvı azot sıcaklıkları için derecelendirilen plastik kriyotüpler, sıvı azot depolaması için önerilir, çünkü cam ampullerden daha sağlam görünürler ve azotta kırılma olasılıkları daha düşüktür. Cam ampuller tavsiye edilmez.
Ampuller ve kriyotüpler, sıvı nitrojenden çıkarıldığında bulaşıcı aerosoller ve damlacıklar oluşturduğunda patlayabilir. Ek bilgi için Bölüm 3.9'a bakın.
8.4. Kişisel Önlemler
Kişisel önlemler tutarlı ve titiz bir şekilde kullanılmazsa, hiçbir güvenlik mühendisliği laboratuvar ortamında fiziksel, kimyasal ve biyolojik riskleri azaltamaz. Tüm laboratuvar çalışanları ve ziyaretçiler, kişisel önlemlerle ilgili belirlenmiş prosedürleri takip etmekten sorumludur. Yöneticiler ve denetçiler biyogüvenlik sorumluluklarını periyodik olarak gözden geçirmelidir (1).
8.4.1. Biyolojik güvenlik kabini
- Sınıf II BSC'de viroloji laboratuvarında tüm kültür manipülasyonlarını yürütün. Bu manipülasyonlar arasında, bunlarla sınırlı olmamak üzere, kültür aşılaması, beslenme, geçiş, hemadsorpsiyon ve hemaglütinasyon testi, virüs seyreltmeleri ve titrasyonları, hücre fiksasyonu, immünofloresan boyama ve kontrollerin ve kontrol slaytlarının hazırlanması yer alır.
- Uygun BSC kurulum ve işletme prosedürlerini izleyin (1). BSC'lerin kullanımına ilişkin kılavuzlar ve BSC tiplerinin özellikleri ve kullanımlarının açıklamaları için Bölüm 3 ve Tablo 5'e bakın.
- BSC'leri NSF/ANSI Standardı 49'a göre yıllık olarak veya kabin taşındıktan sonra, HEPA filtreleri değiştirildikten veya dezenfekte edildikten sonra veya ünite, HEPA filtreleme sisteminin oturmasını veya performansını etkileyebilecek herhangi bir büyük onarımdan geçti.
- BSC'nin içeriğini çıkarın ve BSC'nin içini günlük olarak veya bir dökülme veya kontaminasyon olayından sonra dezenfekte edin.
— Alkolleri BSC'lerde birincil yüzey dezenfektanı olarak kullanmayın, çünkü alkollerin zarfsız virüsler üzerinde çok az etkisi vardır veya hiç etkisi yoktur. Izopropil alkolden gelen buharlar toksik olabilir ve kontakt dermatite neden olabilir. 1:10 ağartıcı çözeltisi en iyi dezenfekte etme aktivitesini sağlar, ancak artık klorun suyla çıkarılmasına dikkat edilmelidir, çünkü klor sonunda paslanmaz çelik yüzeyleri paslandıracaktır.
— Temizlik için kabinin taban plakasını ve ön ızgarayı aylık veya iki ayda bir çıkarın. Zemin plakasını, ızgarayı ve zemin plakasının altındaki plenumu dezenfekte edin.
— Çalışma yüzeylerini, iç duvarları ve pencerenin iç yüzeyini 1:10'luk bir ev tipi çamaşır suyu çözeltisi (1) ile temizleyin, ardından kalan kloru gidermek için bir tane su ile silin ve bir tane %70 etanol (EtOH) ile silin. Kalan kloru çıkarın çünkü sonunda paslanmaz çelik yüzeyleri paslandıracaktır.
— BSC'ye iade edilecek tüm öğeleri silin.
— Herhangi bir partikülü çıkarmak için üfleyicinin en az 4 dakika çalışmasına izin verin.
— Bazı laboratuvarlar kanatları ve üfleyicileri her zaman çalışır durumda bırakırken, diğer laboratuvarlar günün sonunda üfleyiciyi kapatır ve kanatları (eğer varsa) kapatır.
8.4.2. Kişisel koruyucu ekipman
- Genel mikrobiyoloji laboratuvarı için önerilerin çoğu viroloji laboratuvarı için uygundur (Bölüm 3).
- Elleri tehlikeli maddelere ve aşırı sıcaklıklara maruz kalmaktan korumak için eldivenler giyilmelidir. Moleküler biyoloji alanında, numuneyi ciltteki nükleazlardan korumak için eldivenler de kullanılır. Belirli lekeleri veya kimyasalları kullanırken eldiven veya diğer KKD kullanımına ilişkin kılavuzlar için Bölüm 8.1-4'e bakın.
8.4.3. Dezenfeksiyon
Genel mikrobiyoloji laboratuvarı için dezenfeksiyon kılavuzları viroloji laboratuvarı için geçerlidir (Bölüm 3).
8.5. Laboratuvar Atıklarının Dekontaminasyonu ve Bertarafı
- Tıbbi atık akışına yerleştirilmeden önce klinik örnekler, hücre kültürleri veya virüs kültürleriyle (eldivenler ve KKD dahil) temas eden reaktifleri veya materyalleri dezenfekte edin. Sıvılar, 1:10 ev tipi çamaşır suyu (Bölüm 3.4.2 ve 3.5) ile muamele edilerek veya otoklavlama ile dezenfekte edilebilir. Tıbbi atıklara yerleştirilmeden önce diğer tüm malzemeleri otoklavlayarak dezenfekte edin.
- Yerel protokollere göre, genellikle 20.000 ppm hipoklorit çözeltileri veya 1 NO NaOH varlığında 1 saat boyunca otoklavlama yoluyla, yerel protokollere göre Creutzfeldt-Jakob veya diğer prion ile ilişkili hastalık şüphesi olan hastalardan alınan örneklerle temas eden örnekleri, reaktifleri, kültürleri ve ekipmanları dekontamine edin.
8.6. Laboratuvarın Temiz ve Kirli Alanları
- Viroloji laboratuvarında, kirli ve temiz alanlar arasındaki ayrım yanlış bir adlandırmadır; laboratuvardaki tüm alanlar bulaşıcı, kimyasal ve fiziksel tehlikelerle karşılaşmak için artan fırsatlar sunar. Laboratuvar önlemleri laboratuvarın tüm alanları için geçerlidir.
- Hücre kültürü hazırlama ve reaktif hazırlama alanları genellikle "temiz" alanlar olarak adlandırılır, çünkü bu alanlarda hiçbir numuneye, güçlendirilmiş nükleik asitlere veya kontrol materyallerine izin verilmez. Bu "temiz" alanları kurmanın ve polislik etmenin amacı, yanlış sonuçlar doğurabilecek reaktif ve hücre kültürü kontaminasyonunu önlemektir. Bunlar laboratuvar alanlarıdır ve laboratuvar önlemleri hala geçerlidir.
8.7. Yüksek Riskli Organizmaların Erken Tanınması
Rutin klinik laboratuvar testleri, beklenmedik bir biyoterörizm olayının ilk kanıtını sağlayabilir ve rutin klinik örnekler, kültürde güçlendirilmesi tehlikeli olan olağandışı veya egzotik bulaşıcı ajanları da barındırabilir. Laboratuvar güvenliğinin tüm temellerine bağlı kalmak gibi, bu olası yüksek riskli organizmaların erken tanınması da kritik öneme sahiptir. Bir süpervizör veya laboratuvar direktörünün müdahalesini gerektiren olaylar listelenmiştir (Tablo 10). Olayların çoğuna yanlışlıkla neden olan eylemler neden olsa ve risk oluşturmasa da, laboratuvar teknisyenleri ve yöneticileri birden fazla yüksek riskli nedenin mümkün olduğunun farkında olmalıdır. Laboratuvarın bu tetikleyici olaylara nasıl yanıt vereceği, laboratuvarın bir BSL-3 tesisine sahip olup olmadığına ve eyalet ve yerel laboratuvar müdahale ağının (LRN) yeteneklerine bağlı olacaktır.
8.7.1. Floresan antikor test tezgahı
- Kontrol smearleri ve diğer pozitif örnekler güçlü bir şekilde lekelendiğinde hücrelerin loş boyanması, zayıf antijen ekspresyonuna, kabuklu lezyonların örneklenmesine ve hücresel bozunmaya bağlı olabilir. Dim boyama, antikor reaktifi antijenik sürüklenmeden kaynaklanan benzer bir antijenik epitop, viral bir alt türün varlığı veya şüphelenmedik bir virüs ile çapraz reaksiyona girdiğinde de ortaya çıkabilir. Bu tip reaksiyon, poliklonal antikorlarla boyama yaparken daha sık meydana gelir.
- Alışılmadık bir boyama modeli (örneğin, genellikle nükleer boyama üreten bir reaktifle benekli sitoplazmik boyama), şüphelenmeyen bir virüsün varlığını gösterebilir.
- Alışılmadık bir hücre tipinde boyama (örneğin, siliyer solunum epitel hücreleri yerine skuamöz hücrelerin boyanması) farklı bir virüsün veya değişmiş bir tropizm ile beklenen bir virüsün varlığını gösterebilir.
- Bu bulguları laboratuvar amirine veya direktörüne bildirin.
8.7.2. Şüpheli veya sıra dışı sonuçlar
- Şap hastalığı, flavivirüsler, çiçek hastalığı, çiçek hastalığı, alfa virüsleri ve hemorajik ateş virüsleri gibi bilinen biyoterörizm veya halk sağlığı acil durumlarının bilinen ajanları, klinik laboratuvarda kullanılan rutin hücre kültürlerinde büyüyecektir. Bir kültür, bu ajanlardan biriyle tutarlı bir sitopatik etki (CPE) paterni üretirse, daha fazla test için açmayın. Hasta/hayvan hakkında daha fazla bilgi için ilgili doktor veya veterinerle iletişime geçin ve daha fazla talimat için eyalet veya yerel LRN laboratuvarı ile iletişime geçin.
- Alışılmadık bir hücre tipinde tanıdık bir CPE modeli ve/veya belirli bir numune kaynağından (örneğin, neredeyse her hücre tipinde hipertrofik yuvarlama üreten bir göz örneği) beklenmedik bir CPE sonucu üreten kültürler, değiştirilmiş veya beklenmedik bir virüsün varlığını gösterebilir. Daha fazla bilgi için doktor veya veterinerle iletişime geçin ve herhangi bir ek test için numuneyi BSL-3 laboratuvarına taşıyın.
- Doğrulayıcı test başarısızlığı, test sırasında antijenik sürüklenme veya operatör hatasından kaynaklanabilir. Polimeraz zincir reaksiyonu (PCR) gibi alternatif doğrulayıcı testler kullanılabilir, çünkü PCR yöntemleri genellikle ek floresan antikor boyamasından daha az risk sunar. PCR testi virüsü tanımlayamazsa, kültürü daha fazla test için BSL-3 laboratuvarına taşıyın.
- Bir BSL-3 laboratuvarı mevcut değilse, viral ajanı tanımlama konusunda yardım için eyalet veya yerel LRN laboratuvarı ile iletişime geçin.
8.7.3. Nükleik asit testi
- Kontroller ve diğer hasta eğrileri normal olduğunda değiştirilmiş bir erime eğrisi şekli, çok fazla pik ve/veya değiştirilmiş bir erime sıcaklığı (Tm) üreten örnekler, zayıf ekstraksiyonu, primer dimerlerin varlığını veya primerler veya problar altında genetik değişiklikleri gösterebilir. Bu sonuçlar, beklenmedik veya olağandışı (kimerik, rekombinant veya reassorant) bir patojenin varlığından da kaynaklanabilir. Yeniden ekstraksiyon ve yeniden test, mütevazı bir ek risk oluşturmaktadır. Sonuçlar olağandışı olmaya devam ederse, numune ek test için LRN laboratuvarına yönlendirilmelidir.
- Değişmiş amplifikasyon eğimlerine sahip PCR örnekleri, primerler ve/veya prob altındaki genetik varyasyonların veya olağandışı bir patojenin varlığının sonucu olabilir. Yeniden ekstraksiyon ve yeniden test, mütevazı bir ek risk oluşturmaktadır. Sonuçlar olağandışı olmaya devam ederse, laboratuvar ek karakterizasyon için numuneyi durumuna veya yerel LRN'ye yönlendirmelidir.
8.8. Elektron Mikroskobu Laboratuvarı ile İlişkili Tehlikeler
Tanısal elektron mikroskobu, bir numunedeki ajanların morfolojik tanımlanması için nispeten basit ve hızlı bir yöntem olabilir. Elektron mikroskobu prosedürleri, nükleik asit veya immünoassay protokolleri (192) tarafından saptanamaz hale getiren genetik veya immünolojik özellikleri değiştiren yeni organizmaları veya organizmaları tespit etmek için genel bir ekran görevi görebilir. Elektron mikroskobu laboratuvarları, viroloji laboratuvarı için açıklanan fiziksel, kimyasal ve biyolojik tehlikelerin çoğunu paylaşır, ancak aynı zamanda bazı benzersiz özelliklere de sahiptir.
8.8.1. Yanıcı ve yanıcı sıvılar
Elektron mikroskobu laboratuvarı çok çeşitli yanıcı çözücüler kullanır ve açık alevlerin kullanımı önerilmez (bkz. Bölüm 8.2.13).
- Açıkta kalan elektrik bağlantılarını en aza indiren ve kıvılcım oluşturma fırsatını azaltan özel yanıcı depolamalı buzdolaplarına soğutma gerektiren çözücüleri yerleştirin.
- Yanıcı sıvıları yerel ve eyalet yönetmeliklerine uygun olarak yanıcı-depolama dolaplarında saklayın.
- Buhar birikimini en aza indirmek için davlumbazlardaki yanıcı sıvıları tutun. Bir aseton banyolarındaki Wehnelt kapak tertibatlarının ultrasonik temizliği, kimyasal bir davlumbazda yapılmalıdır.
- Yanıcı sıvıları asla tahliyeye dökmeyin çünkü patlamaya neden olabilirler.
8.8.2. X-ray tehlikeleri
Elektron mikroskobu, yüksek enerjili elektronlar metal bileşenlere çarptıkça mikroskop içinde tehlikeli seviyelerde X-ışınları üretecektir. Modern elektron mikroskopları, operatör için tehlikeleri en aza indiren yeterli koruma ve kurşun emdirilmiş cam görüntüleme portlarına sahiptir. Ancak, cihazda yapılan değişiklikler, aksesuarların eklenmesi ve çıkarılması ve bazı bakım prosedürleri ekranlamayı tehlikeye atabilir.
- Koruyucu etkinliği doğrulamak ve radyasyon seviyelerini izlemek için kalibre edilmiş bir ince pencere Geiger-Müller (GM) anket ölçer kullanın
- başlangıçta kurulum sırasında;
- mikroskop ne zaman değiştirilse; ve
— eyalet, yerel veya kurumsal politikalar tarafından belirtildiği gibi periyodik olarak. - Radyasyon seviyeleri üniteden 5 santimetre uzakta <0,5 mR olacaktır.
8.8.3. Elektrik tehlikeleri
Elektron mikroskobu laboratuvarında rutin elektrik güvenliği ile ilgili bilgi için Bölüm 3.7'ye bakın.
- Laboratuvarda elektron mikroskoplarına ve diğer ekipmanlara güç sağlamak için özel yüksek voltajlı ve yüksek amperli elektrik kaynakları kullanılır. Bu ekipmana sadece eğitimli teknisyenler servis verecek. Cihaza servis verilirken elektrik devrelerinin etkinleştirilmesini önlemek için güvenlik kilitleri ve güç kilitlemeleri takın.
- Yüksek voltajlı elektron tabancasındaki filamanın değiştirilmesi, topraklama çubuğunun Wehnelt kapağıyla temas etmemesi durumunda elektrik tehlikesi oluşturabilir. Kapak üzerinde önemli bir yük birikebilir ve kapağa dokunmadan önce şarjın giderilmesi gerekir.
8.8.4. Kimyasal tehlikeler
Elektron mikroskobu laboratuvarında çeşitli ağır metal lekeleri ve agresif fiksatifler kullanılmaktadır. Lekeleri ve fiksatifleri işleme yönergeleri için Üreticiler tarafından sağlanan Bölüm 8.2 ve MSDS materyallerine bakın. Gömme ve film yapımı malzemeleri kimyasal tehlikelerdir ve bu malzemelerin çoğu yanıcı organik çözücülerde çözülür.
- Bu kimyasallara akut ve uzun süreli maruziyeti sınırlayın.
- Potansiyel olarak tehlikeli kimyasallara maruz kalmayı en aza indirmek için fırınları kimyasal bir davlumbazın içine yerleştirin.
- Lateks eldiven tüm kimyasallar için uygun değildir ve tüm laboratuvar personeli için uygun eldiven kullanımı vurgulanmalıdır.
8.8.5. Kriyojenler ve sıkıştırılmış gazlar
Elektron mikroskobu laboratuvarında en sık kullanılan kriyojenler sıvı azot ve sıvı helyumdur. Ayrıca sıkıştırılmış helyum, CO ve azot da kullanılmaktadır. Bu gazlarla ilişkili tehlikeler ve güvenlik önlemleri Bölüm 3.8 ve 3.9'da özetlenmiştir.
8.8.6. Özel ekipman
Elektron mikroskobu laboratuvarı, kullanımı tehlikeli olabilecek bir dizi özel cihaz kullanır. Örneğin, evaporatörler, freeze-kuruis, freeze-fracture ve püskürtme kaplayıcı üniteleri vakum kullanır ve kaplar patlayabilir. İmplozyon tehlikeleri Bölüm 3.13.1'de gözden geçirilmiştir.
- Buharlaşma sırasında göz hasarını önlemek için, kaynağı görüntülemek için kaynakçı gözlüklerini kullanın.
- Dokunmadan önce bileşenlerin soğumasına izin verin.
- Yüzeyden dökülebilecek buharlaştırılmış metalden hiçbirini solumayın.
- Kritik nokta kurutucular, "bomba" (121,193) içinde oluşan yüksek basınçlar nedeniyle oldukça tehlikeli olabilir. Güvenli çalışma için kullanım kılavuzunda açıklanan çalışma ve güvenlik prosedürlerini izleyin.
— Operatör ve bomba arasına yarım inç kalınlığında bir lexan kalkan yerleştirin.
— Kalkanı doğrudan bombanın penceresinin üzerine, bir patlamanın tüm kuvvetini alacağı yere sabitlemeyin. Bu güç kalkanı paramparça edebilir.
— Bombanın içeriğini gözlemlerken polikarbonat bir yüz siperi de önerilir.
— Doğrudan dışarıda veya bir davlumbazdan kritik nokta kurutuculardan havalandırma freons veya freon ikameleri.
8.8.7. Biyolojik tehlikeler
Elektron mikroskobu laboratuvarının biyolojik tehlikeleri viroloji laboratuvarınınkine benzerdir ve iyi laboratuvar uygulamaları takip edilmelidir.
- Aerosolleri ve laboratuvarın kontaminasyonunu önlemek için birincil numune kullanımını biyolojik güvenlik kabininde gerçekleştirin.
- Negatif boyama çözeltileri mikroorganizmaları ve virüsleri etkisiz hale getirmeyebilir. Osmiyum tetroksit etkili bir sterilanttır, ancak tüm örnekler için kullanılamaz.
8.9. Hızlı Test (Kitler)
Viral antijenler ve antikorlar için FDA onaylı, hızlı immünognostik testler mevcuttur. Başlangıçta bakım noktası veya bakım noktasına yakın test için tasarlanan bu testlerin çoğu klinik viroloji laboratuvarlarında test için kullanılıyor. Aşağıdaki biyogüvenlik önerileri, 2009-H1N1 influenza A virüsü (194) içeren klinik örnekleri veya izotları işlemek için CDC biyogüvenlik kılavuzuna dayanmaktadır.
- Bir sürüntünün ortama veya pipetlama numunelerine ve reaktiflerine yerleştirilmesi gibi yalnızca basit adımları içeren ve aerosol üretmesi makul bir şekilde beklenmeyen prosedürler, yalnızca sıçrama koruması kullanılarak tezgah üstünde gerçekleştirilebilir. Santrifüjleme, girdaplama, kuvvetli karıştırma veya aerosol üretebilecek diğer yöntemler gerektiren test prosedürleri için BSC'yi kullanın.
- Tezgah üstü testi sıçramaları ve aerosol oluşumunu önleyecek şekilde gerçekleştirin. Bu tür testler için uygun KKD, bir laboratuvar önlüğü, eldiven, göz koruması ve cerrahi, diş, tıbbi prosedür, izolasyon veya lazer maske gibi bir yüz maskesinden oluşur. Tüm yüzün korunmasını sağlayan bir sıçrama kalkanı, ayrı göz koruması ve yüz maskesi ihtiyacını karşılar.
- Numuneler işlendikten sonra çalışma yüzeylerini ve ekipmanı mümkün olan en kısa sürede 1:10 ağartıcı çözeltisi ile dekontamine edin.
- Sınıf II BSC'de yapıldığında hızlı immünodiagnostik test, ek göz koruması ve yüz maskesi kullanımı gerektirmez.
8.10. Moleküler Laboratuvar
Moleküler viroloji laboratuvarları, viroloji laboratuvarı için açıklanan fiziksel, kimyasal ve biyolojik tehlikelerin çoğunu paylaşır, ancak aynı zamanda bazı benzersiz tehlikeler de sunarlar.
8.10.1. Elektrik tehlikeleri
Moleküler viroloji laboratuvarında rutin elektrik güvenliği ile ilgili bilgi için bkz. Bölüm 3.7. Elektroforez ve nükleik asit dizileme ekipmanlarında özel yüksek voltajlı güç kaynakları kullanılmaktadır.
- Bir ark patlamaya veya yangına neden olabileceğinden, yanıcı sıvıların ve gazların yakınında asla yüksek voltajlı elektrikli ekipman kullanmayın.
- Cihazı sökmeden önce elektroforez ekipmanına olan gücü kesin.
- Sadece eğitimli teknisyenler yüksek voltajlı elektrikli ekipmanlara servis yapmalıdır.
- Elektroforez ekipmanında güvenlik kilitlerini ve güç kilitlerini asla kurcalamayın veya yenmeyin.
8.10.2. Ultraviyole ışık tehlikeleri
- Kısa dalga ultraviyole (UV) görünüm kutuları genellikle jellerdeki nükleik asit bantlarını görselleştirmek için kullanılır. Bir UV görünüm kutusunda jelleri görselleştirirken ve fotoğraflarken gözleri korumak ve cildi tamamen örtmek için özel dikkat gösterilmelidir.
- UV görüntü kutularıyla çalışırken eldiven, uzun kollu laboratuvar önlüğü ve UV'ye dayanıklı tam yüz kalkanı giyin.
- Bu amaçla sadece kısa dalga UV ışığı için derecelendirilmiş yüz siperliklerini kullanın.
- UV görüntüleme kutularını laboratuvarın normal trafik akışından bulun, böylece seyirciler veya oradan geçen kişiler ultraviyole ışığa maruz kalmaz. Diğer UV ışığı tehlikeleri Bölüm 3.12'de ele alınmıştır.
8.10.3. Kimyasal tehlikeler
Moleküler viroloji laboratuvarına özgü kimyasal tehlikeler arasında kloroform, etidyum bromür (Bölüm 8.2.8) ve guanidinyum bazlı ekstraksiyon reaktifleri (Bölüm 8.2.10) bulunmaktadır. Bunlara akut ve uzun süreli maruz kalmaktan kaçının.
8.10.4. Biyolojik tehlikeler
Moleküler viroloji laboratuvarındaki biyolojik tehlikeler viroloji laboratuvarınınkilere benzer ve iyi laboratuvar uygulamaları takip edilmelidir.
- Aerosolleri ve laboratuvarın kontaminasyonunu önlemek için birincil numune kullanımını biyolojik güvenlik kabininde gerçekleştirin.
- Ekstrakte edilen nükleik asitler steril olabilir veya olmayabilir. Yetersiz bir şekilde gerçekleştirilen bir ekstraksiyon prosedürü, numunedeki bulaşıcı ajanları tamamen çıkarmayabilir veya inaktive etmeyebilir. Pozitif sarmallı RNA virüslerinin (poliovirüs) genomunun bulaşıcı olduğundan şüpheleniliyor ve hücreye girdikten sonra, viral genom, virüs replikasyonu için virüs kodlu proteinler veya aksesuar bileşenler gerektirmez. Bu şekilde enfeksiyon riskleri çok küçük olsa da, ekstrakte edilen viral nükleik asitleri bulaşıcıymış gibi ele almak ihtiyatlıdır. Bu uygulama, laboratuvarın diğer alanlarında kullanılan numune işleme prosedürlerini yansıtır ve tüm laboratuvar için birleşik bir numune işleme politikasını destekler.
9. Kimya Laboratuvarı
Kimya, toksikoloji veya ilaç testi laboratuvarı tarafından test edilen insan ve hayvan kökenli tüm örnekler bulaşıcı ajanlar içerebilir. Yüzey teması, aerosolizasyon veya nüfuz eden yaralanma yoluyla hasta örneklerine maruz kalma riskini anlamak ve en aza indirmek zorunludur. Laboratuvardan edinilen enfeksiyonların risk azaltımı Bölüm 2 ve 3'te ele alınmıştır.
9.1. Otomatik Analizörler (ayrıca bkz. 3.17.3 ve 10.6.3)
Otomatik analizörler, operatör maruziyetlerini azaltmaya yardımcı olmak için sıklıkla özellikler eklemiştir, ancak maruz kalma potansiyelini tamamen ortadan kaldırmazlar. Daha yeni sistemlerde ortak bir özellik, kapalı sistem örneklemesidir.
- Kimya/toksikoloji analizörleri genellikle cilt delinmelerine ve yırtıklara neden olabilecek yüksek hızlı robotik kollara ve örnekleyicilere sahiptir. Analizörleri sadece kapak kapalıyken çalıştırın.
- Hızlı hareket eden veya hızlı sıvı veren örnek problar aerosoller ve damlacıklar oluşturabilir.
- Her zaman üreticinin talimatlarına göre aletler kullanın.
- Kullanım sırasında cihaz güvenlik kalkanlarının ve muhafaza cihazlarının yerinde olduğundan emin olun.
— Numune probu ve sıvı seviyesi sensörlerinin yakınındaki el hareketi miktarını sınırlayın.
— Operatörün numune aldıktan sonra numune problarını silmesi gereken cihazları kullanırken, tek kullanımlık eldivenler giyin ve bir tarafında sızdırmaz plastik kaplamalı gazlı bezler kullanın. Daha yeni cihazlar, bu maruz kalma kaynağını ortadan kaldıran otomatik prob yıkama döngülerine sahiptir. - Dökülmeyi önlemek için, numune tepsilerini ve numuneleri dikkatli bir şekilde kullanın ve manipüle edilmediğinde kapalı tutun.
- Kan tüplerinin dışının kontamine olduğunu varsayın ve tüpün dışını laboratuvar dezenfektanı veya 1:10 ev tipi çamaşır suyu çözeltisi ile silmeye hazır olun.
- Numune kaplarını ve aliquot tüplerini mekanik cihazlar (örn. transfer pipetleri) kullanarak doldurun ve asla boşaltın (dökmeyin).
- Klinik analizör atıklarının patojenlerle kontamine olduğunu düşünün; bazıları tehlikeli kimyasallarla da kontamine olabilir. Elden çıkarmaları eyalet ve yerel düzenlemelere uygun olmalıdır. Bu atıkları araştırın ve kanalizasyona boşaltmadan önce geçerli standartlara bakın.
- Uygun kişisel koruyucu ekipman (PPE) ve kullanılacak temizleme solüsyonu türü de dahil olmak üzere, bir cihazın üzerinde veya içindeki numune dökülmelerinin rutin temizlik ve sorun giderme için üretici talimatlarını izleyin.
— Üretici talimatları dökülme muhafazası ve temizleme talimatlarını içermediğinde, operatörü etkili bir şekilde koruyacak ve cihazın operasyonel ömrünü koruyacak ve uzatacak standart bir çalışma prosedürü (SOP) geliştirmek için üretici ile işbirliği yapın.
— Üretici tarafından klorun cihaz bileşenlerine zarar vermeyeceğinden emin olduktan sonra acil bir dökülme veya kırılma durumunda taze 1:10 ev tipi ağartma çözeltisini elinizde bulundurun. - Üretici talimatlarını izleyerek akışkan sistemlerin ve numune alıcısının günlük temizliğini gerçekleştirin.
- Atıkları, şişe dolduğunda %10 çamaşır suyu konsantrasyonu elde etmek için yeterli miktarda taze konsantre ev tipi çamaşır suyu içeren bir atık kabına toplayın. Klor gazı oluşumunu önlemek için ağartıcı ile uyumlu olmayan bileşikler (Tablo 11) içeren atıkları ağartıcıya toplamayın.
- Yeterli mühendislik kontrolleri ve KKD mevcut olmadığı sürece sodyum hipokloriti (çamaştırı) başka bir kimyasal maddeyle karıştırmayın. Kazara karıştırma, personelin yaralanmasına ve/veya mülke veya çevreye zarar vermesine neden olabilecek tehlikeli koşullara neden olabilir.
9.2. Kimyasal/Toksikolojik Analiz için Doku Hazırlığı
- Hasta tanısı veya sipariş edilen test(ler) ne olursa olsun, sabitlenmemiş tüm dokuları biyolojik olarak tehlikeli olarak düşünün.
- Bir fiksatif kullanımı her zaman tüm biyolojik tehlikeleri ortadan kaldırmak için yeterli değildir.
- Numune aspirasyonu için sabit bir muhafaza cihazı ile önlük ve eldiven dahil bir biyolojik güvenlik kabini (BSC) veya KKD kullanın.
- Otomatik numune yükleme sistemleri, numune işlemeyi azaltır ve ayrıca operatörün aerosollere ve sıçramalara maruz kalmasını önleyen bir muhafazada numune girdabı gerçekleştirir.
— Numuneleri alet tüpü raflarına yüklerken özellikle dikkatli olun.
— Sabitlenmemiş numuneler için, BSC'nin içine alet tüp raflarını yükleyin veya sıçramalardan ve aerosollerden korumak için KKD giyin.
9.3. Spesifik Analizör Riskleri
Analizör atıkları veya proseslerinde aktif biyolojik tehlike riskini yeterince değerlendirmek için risk analizi, spesifik analizörlerin kullanımından önce meydana gelen prosedürlerin değerlendirilmesiyle başlamalıdır. Numune hazırlama protokolleri virüsleri ve bakterileri tamamen etkisiz hale getirebilir, böylece analizör atıklarında biyolojik olarak tehlikeli aerosol oluşumu riski esasen sıfırdır. Bir örnek, sıvı kromatografide protein çökeltme tekniklerinin veya protein denatüre çözücülerin kullanılmasıdır, bu da analizör tarafından üretilen aerosoller veya atık sulardaki biyolojik tehlike endişelerini ortadan kaldıracaktır.
9.3.1. Grafit fırınlar
- Buharlaşmadan önce tamamen kuru numuneler.
- Enfeksiyöz ajanların ortam havasına kaçmamasını sağlamak için numuneleri buharlaştırmak için ısı kullanan cihazları yeterince havalandırın.
- Alet kullanımdayken, üreticinin tavsiyelerine uygun olarak, alet kapaklarını ve panelleri kapalı ve sabit tutun.
9.3.2. Kütle spektrometreleri
- Kütle spektrometreleri, sıvı kromatografisi (LC-MS) atıklarından seçilen iyonları izlemek için programlanmış tespit cihazları olarak kullanıldığında, analizör işleminden önce bir risk değerlendirmesi, numune hazırlama prosedürlerinin bulaşıcı ajanları inaktive etmediğini gösterirse, atık sudaki bulaşıcı ajanlara maruz kalma gerçekleşebilir.
- Numuneleri iyonize etmek için tahribatsız (yumuşak) teknikler kullanan cihazlar, örn. sonik sprey iyonizasyonu, ön analiz süreci risk değerlendirmesi, numune hazırlama prosedürlerinin bulaşıcı ajanları inaktive etmediğini gösteriyorsa, operatörlere maruz kalma riski oluşturabilir.
10. Hematoloji ve Flebotomi Laboratuvarı
10.1. Numune Alma ve Oturum Açma/Kurulum İstasyonu
Hematoloji laboratuvarı için biyogüvenlik kılavuzları, mikrobiyoloji laboratuvarı için olanlarla aynıdır ve Bölüm 3.1'de açıklanmıştır.
10.2. Açık Tezgahta Çalışın
Bkz. Bölüm 3.2.1.
10.2.1. Standart işletim prosedürleri
Standart işletim prosedürleri Bölüm 3.1.4'te açıklanmıştır.
10.2.2. Kapalı kapakların ve numunenin manuel olarak çıkarılması aliquoting/pipetting
Bkz. Bölüm 3.1.5.
10.2.3. Sabitlenmemiş numuneler
- Mikroskoplar
— Sahneyi, göz merceklerini, düğmeleri ve diğer kirlenmiş parçaları günlük olarak dezenfekte edin.
— Mikroskopta aşındırıcı olmayan ve potansiyel bulaşıcı ajanlar için uygun bir dezenfektan seçin. - Slayt hazırlıkları
— Havada slaytlar sallamaktan veya açık bir tezgahta elektrikli fanlar kullanmaktan kaçının ve kızakları kurutun.
— Bir elektrikli fan, bir duman davlumbazında ve yalnızca gerekirse tezgahın üstünde değil, biyolojik bir güvenlik kabininde (BSC) kızakları havayla kurutmak için kullanılabilir. BSC'de bir fan kullanmak hava akışını bozacak ve hava akışı stabilize olana kadar BSC'yi diğer laboratuvar çalışmaları için uygun hale getirmeyecektir. - Buffy ceket lekeleri
Cam tüpleri kesmek ve kan ve cam parçalarına maruz kalmaktan kaçınmak için kılcal tüpler yerine tek kullanımlık Wintrobe tüpleri kullanın. - Hemasitometre
Cam kırıklarından kaynaklanan delinmeleri önlemek için cam hemasitometreler ve cam kapaklar kullanırken çok dikkatli olun. Plastik hemasitometreler ticari olarak temin edilebilir ve tekrarlanabilir ve güvenilir ölçümler ve analizler sunar. Birkaç hemasitomer tasarımı, kapakların kullanımını ortadan kaldırır ve tam ses kontrolüne izin verir. - Kanama süreleri (195)
— Eldiven giyin (bkz. Bölüm 3.2.2 ve 8.4.2).
— Uygun pediatrik/yetişkin şablon güvenlik cihazlarını kullanın.
— Cihazların İş Güvenliği ve Sağlığı İdaresi (OSHA) Kan Yolundaki Patojenler Standartları (33) ve CDC kılavuzlarına (196) uygun olarak yıllık olarak gözden geçirilmesini sağlayın.
— Test bölgesinden kol kıllarının çıkarılması gerektiğinde tek kullanımlık tıraş makineleri kullanın.
— Kullanılmış kanama süresi cihazını ve tıraş bıçağını kesici alet kabına ve filtre kağıdını tıbbi atık kabına atın. - Kemik iliği aspire eder
— Laboratuvar politikasına ve bu ortamlarda toplandığında kemik iliği aspiratlarının toplanması için prosedüre hasta bakım ayarları için uygun hastane enfeksiyon kontrol politikalarını ve prosedürlerini ekleyin.
— Hasta odalarına getirilenleri sınırlayın. Kemik iliği güvenlik tepsisi kitleri birkaç üretici tarafından pazarlanmaktadır. Tek kullanımlık trephine ve aspirasyon iğnelerinin kullanılması önerilir.
— Laboratuvarda numuneleri toplayın ve kabak lekeleri ve slaytlar hazırlayın.
— Smear'ler laboratuvar dışında, örneğin hasta bakım ortamlarında hazırlanmalıysa, Standart Önlemleri kullanın; ne ve ne zaman ek kişisel koruyucu ekipman (KKD) uygun olabileceğini belirlemek için risk ve tehlike değerlendirmesini kullanın; smear ve slaylar hazırlamak için düz bir güvenli yüzey kullanın; ek numunelerdeki kapakların/kapakların nakliyeden önce sıkıca sabitlendiğinden emin olun; ve slayların, kabak lekelerinin ve ek numunelerin sızdırmaz ve kırılmaya dayanıklı kaplarda taşınmasını sağlayın. - Laboratuvar personelinin eğitimini belgeleyin ve yetkinliğini değerlendirin. Tüm belgelenmiş eğitim ve yetkinlik değerlendirmelerine, hasta ortamlarında hastane enfeksiyon kontrol politikaları/prosedürleri ve Standart Önlemler kavramı hakkında bilgi ve bunlara bağlılığı dahil edin.
10.3. Kişisel Önlemler
BSC (Bölüm 3.3), KKD (Bölüm 3.2.1) ve dezenfeksiyon (Bölüm 3.4) kullanımı da dahil olmak üzere kişisel önlemler için kılavuzlar Bölüm 3'te açıklanmıştır.
10.4. Laboratuvar Atıklarının Dekontaminasyonu ve Bertarafı (39)
Laboratuvar atıklarının dekontaminasyonu ve bertarafı için kılavuzlar için Bölüm 3.5'e bakın.
10.5. Laboratuvarın Kirli ve Temiz Alanları
Bkz. Bölüm 3.16.
10.6. Enstrümantasyon
Otomatik veya manuel olsun, numune aerosolleri ve damlacıkları üretme potansiyeline sahip prosedürler (örneğin, stoper çıkarma, vorteksleme, tahliye edilmiş tüpleri açma veya delme, otomatik numune dağıtıcıları), bulaşıcı ajanlara maruz kalmayı önlemek için tasarlanmış KKD veya mühendislik kontrolleri gerektirir.
10.6.1. Su banyoları
Bkz. Bölüm 3.17.1.
10.6.2. Santrifüjler
Bkz. Bölüm 3.17.2.
10.6.3. Otomatik hematoloji/hemostaz analizörleri
Otomatik analizörler, operatör maruziyetlerini azaltmaya yardımcı olmak için sıklıkla özellikler eklemiştir, ancak bunlar maruz kalma potansiyellerini tamamen ortadan kaldırmaz. Daha yeni sistemlerde ortak bir özellik, kapalı sistem örneklemesidir. Ek bilgi için Bölüm 3.17.3, 9.1 ve 11.6.3'e bakın.
- Hızlı hareket eden veya hızlı sıvı veren örnek problar aerosoller ve damlacıklar oluşturabilir.
- Her zaman üreticinin talimatlarına göre aletler kullanın.
- Kullanım sırasında cihaz güvenlik kalkanlarının ve muhafaza cihazlarının yerinde olduğundan emin olun.
- Numune probu ve sıvı seviyesi sensörlerinin yakınındaki el hareketi miktarını sınırlayın.
- Operatörün numune problarını silmesi gereken aletleri kullanırken eldiven giyin ve bir tarafında sızdırmaz plastik kaplamalı gazlı bez kullanın. Daha yeni cihazlar, bu maruz kalma kaynağını ortadan kaldıran otomatik prob yıkama döngülerine sahiptir.
- Numune tepsilerini ve numune plakalarını dikkatli bir şekilde tutun ve dökülmeyi önlemek için numune alınmadığında örtün.
- Numune kaplarını ve aliquot tüplerini mekanik cihazlar kullanarak doldurun ve asla boşaltmayın (dökmeyin).
- Klinik analizör atıklarının kontamine olduğunu varsayın ve geçerli federal, eyalet ve yerel çevre düzenlemelerine uygun olarak atın.
- Uygun KKD ve kullanılacak temizleme solüsyonu türü de dahil olmak üzere, bir cihazın üzerinde veya içindeki numune dökülmelerini rutin temizleme ve sorun giderme için üretici talimatlarını izleyin.
- Üretici talimatları dökülme muhafaza ve temizleme talimatlarını içermediğinde, operatörü etkili bir şekilde koruyacak ve cihazın çalışma ömrünü koruyacak ve uzatacak standart bir işletim prosedürü geliştirmek için üretici ile işbirliği yapın.
10.6.4 Akış sitometreleri (bkz. Bölüm 3.17.3)
Rutin akış sitometrisi (FCM) laboratuvarındaki mesleki maruziyetler ya numune işlemeden ya da daha spesifik olarak akışın kendisi tarafından üretilen aerosollerden ve damlacıklardan kaynaklanır. Aşırı yüksek basınç ayarlarına sahip jet-in-air akış sitometreleri kullanılarak gerçekleştirildiğinde, fenotipik analiz, kalsiyum akısı değerlendirmeleri ve sabitlenmemiş hücrelerin apoptoz ölçümleri gibi akış sitometrik uygulamaları, operatörleri potansiyel olarak tehlikeli aerosollere maruz bırakabilir.
- FCM biyogüvenlik prosedürleri özellikle aerosol muhafaza, atık yönetimi ve ekipman bakımına odaklanmalıdır (197).
- Sabitlenmemiş tüm malzemeleri (periferik lökositler, kemik iliği, çeşitli vücut sıvıları, kültürlenmiş hücreler ve çevresel örnekler) biyolojik olarak tehlikeli olarak düşünün.
— Tüm biyolojik tehlike türlerini ortadan kaldırmak için bir fiksatif kullanımı her zaman yeterli değildir.
— Numune aspirasyonu için eşdeğer bir sabit muhafaza cihazı ile bir BSC veya KKD kullanın.
— Bir akış sitometresini çalıştırırken daima tek kullanımlık eldivenler ve koruyucu giysiler giyin.
— Potansiyel olarak biyolojik olarak tehlikeli hücre sıralama gerçekleştirmek için yalnızca belgelenmiş eğitim ve deneyime sahip operatörlere (profesyonel fikir birliği 2 yıldır) izin verin (51).
— Sıralama sırasında yalnızca gerekli personele izin vererek erişimi kısıtlayın. Girişte hücre sıralama işleminin devam ettiğine dair bir bildirim gönderin. Sıralamayı izlemek isteyen personel, hücre sıralayıcının operatörüyle aynı KKD'yi giymelidir. - Cell-sorters, bir mikro damlacık jeti oluşturmak için bir nozul ile donatılmıştır; bu adımın aerosol üretmesi muhtemeldir.
- Tıkanmış sıralama nozulu veya akışkan sistemdeki hava gibi alet arızaları, aerosol oluşumunu büyük ölçüde artırabilir.
- Hücre ayıklayıcıları için yeni tasarlanmış güvenlik ataşmanları ticari olarak satışa sunuldu. Bazı kapalı sıvı sistemi akış sitometreleri, bir sıvı değiştirme mekanizması kullanarak hücre sıralama gerçekleştirir. Bu sitometreler, jet-in-air hücre sıralayıcılarının aksine, hücre sıralama sırasında aerosol üretmez.
- Ayıklama cihazları üzerindeki aerosol kontrol önlemlerinin etkinliği, özellikle sabitlenmemiş insan hücreleri ve bilinen biyolojik olarak tehlikeli numuneler alındığında veya sıralandığında, üretici talimatlarına göre periyodik olarak test edilmelidir.
- Verimliliği ölçmek için daha basit boncuk tabanlı teknoloji geliştirilmiştir.
- Daha yeni akış sitometreleri, operatörün cihaz tarafından üretilen numune damlacıklarına ve aerosollere maruz kalma riskini azaltmak için biyogüvenlik özellikleri (örneğin kapalı akış hücreleri, damlacık muhafaza modülleri ve otomatik örnekleyiciler) eklemiştir.
- Cihazın üretici tarafından belirtilen şekilde kullanıldığından emin olun.
- Alet kapağını dikkatli bir açıp kapatın.
- Alet kullanımdayken alet kapaklarını ve panelleri kapalı ve güvenli tutun.
- Güvenlik kilitlerini ve/veya sensörleri devre dışı bırakmayın.
- Numune tüplerini numune giriş portuna güvenli bir şekilde yerleştirin. Aksi takdirde, basınçlandırıldıktan ve numune operatörün üzerine sıçratıldıktan sonra havaya uçurulabilir.
— Bazı numune portları, tüp dikkatli bir şekilde yerleştirilmediğinde eldivenlere zarar verebilecek metal bir yudum tüpü içerir.
— Daha iyi sıçrama koruması için, satın alma sırasında koruyucu gözlük veya kimyasal sıçrama gözlüğü takılması önerilir.
— Otomatik numune yükleme sistemleri, numune işlemeyi azaltır ve ayrıca operatörün aerosollere ve sıçramalara maruz kalmasını önleyen bir muhafazada numune girdabı gerçekleştirir. Bu sistemler ile alet borusu raflarına numune yüklerken özellikle dikkatli olun. Sabitlenmemiş numuneler için, bir BSC'nin içine alet tüpü rafları yükleyin veya sıçramalardan ve aerosollerden korumak için KKD giyin. - Üretici talimatlarını izleyerek akışkan sistemlerin ve numune alıcısının günlük temizliğini gerçekleştirin.
- Atıkları, kap dolduğunda %10'luk bir nihai konsantrasyon elde etmek için yeterli miktarda taze konsantre ev çamaşır suyu içeren bir atık kabına toplayın.
Not: Amonyum klorür Tris tamponunun bir parçalama maddesi olarak kullanıldığı bir atık kabına klor eklenmesi tehlikeli klor gazı açığa çıkarabilir. Bunun yerine geniş spektrumlu bir idofor kullanın.
10.6.5. Otomatik slayt boyayıcılar
- Cihazın üretici tarafından belirtilen şekilde kullanıldığından emin olun.
- Alet kullanımdayken alet kapaklarını ve panelleri kapalı ve güvenli tutun.
10.6.6. Toplam veya yarı otomatik hematoloji test sistemleri
- Maruz kalma riski oluşturan kritik operasyonları belirlemek için tehlike ve risk değerlendirmeleri yapın.
- Standart işletim prosedürleri şunları içermelidir:
- konveyör yolları, kayışlar, sıralayıcı, alikut ve kapak delici prob istasyonlarındaki tüp kırılması ve numune dökülmelerini gidermek için talimatlar;
- tüp kırılması ve/veya numune dökülmelerinden sonra en az günlük temizlik ve dezenfeksiyon ve temizlik gerektiren talimatlar; ve
— robotik temizliği ve sorun gidermesi için uygun KKD.
Not: HEPA filtreleri veya forseps ile tutulan pamuk bant, ince cam parçacıklarını çıkarmak için yararlıdır. - Talimatlar üretici tarafından sağlanmadıysa, operatörü koruyacak ve robotik ekipmanla uyumlu olacak ve kullanım ömrünü uzatacak sorun giderme ve temizleme prosedürleri geliştirmek için üretici ile işbirliği yapın.
10.7. Hızlı Test (Kitler) (Bölüm 3.18)
Kullanılmış test kitlerinin kontamine olacağını düşünün ve bunları geçerli yerel ve eyalet çevre düzenlemelerine uygun olarak uygun şekilde atın.
10,8. Moleküler Test (198)
- Klinik ve Laboratuvar Standartları Enstitüsü, hematopatoloji için nükleik asit amplifikasyon deneyleri için standartlar yayınlamıştır (199).
- Açık tezgah ve cihaz operasyonları için standart laboratuvar güvenliği yönergelerine ek olarak, tek yönlü iş akışına ve çalışma alanlarının mekansal ayrımına kesinlikle uyulmalıdır.
— Reaktif hazırlığı en temiz alan, ardından numune hazırlama alanı ve son olarak ürün tespit alanıdır.
— Belirlenen her alanda taşınabilir eşyalar, örn. kalem, bant, makas, eldiven kutusu bırakın (bkz. Bölüm 3.19). Her alanı renk kodlaması ve renk kodlu bant ve renk kodlu laboratuvar kaplamaları kullanmak, çalışma alanlarının mekansal ayrımlarını zorlamaya ve taşınabilir araçları belirlenen alanlarda tutmaya yardımcı olur.
— Her alana girmeden önce laboratuvar önlüklerini ve eldivenlerini değiştirin ve ellerinizi yıkayın (bkz. Bölüm 3.19).
10,9. Flebotomi
- Klinik bakım için kabul edilebilir ve yaralanmalara karşı optimum koruma sağlayan mühendislik kesici yaralanma önleme cihazlarını değerlendirin, seçin ve kullanın. Tasarlanmış kesici alet yaralanma önleme cihazlarının değerlendirilmesi ve olası kullanımlarının dikkate alınması, keskin uç kullanan çalışanları içermelidir.
- Keskin araç yaralanma önleme cihazlarının yıllık değerlendirmesini ve seçimini sağlayan bir süreç oluşturun (196; Bölüm 3.14).
10.9.1. Genel öneriler (200–203)
- Keskin atma kaplarının hasta odalarında ve hasta çizim alanlarında kolayca erişilebildiğinden emin olun; asla dörtte üçünden fazla dolu değildir; ve keskin arp yaralanma önleme cihazlarının yıllık değerlendirmesine, seçimine ve kullanımına dahil edilir (204).
- Hasta çizim alanlarında tüm geçerli hasta bakımı ve enfeksiyon kontrol politikalarına ve prosedürlerine sıkı sıkıya uyulmasını sağlayın.
- Kan yoluyla bulaşan patojenlere karşı dış ve iç maruziyete karşı korumak için ellerinizi basit sabun ve su veya antimikrobiyal solüsyonla yıkayın. Eldivenlemeden önce; eldiven çıkarıldıktan sonra; her hasta veya hasta numunesiyle temastan sonra; laboratuvardan, çizim istasyonundan veya hasta odasından ayrılmadan önce; yemekten önce; ve eller muhtemelen kontamine bir yüzeye dokunduktan sonra ellerin yıkandığından emin olun.
- Tesis içinde ve varsa tesis dışında numune taşınması için bir süreç ve prosedür oluşturun (93).
— Hasta örnekleri çekme istasyonundan tesisin başka bir alanına taşınırsa, sıkı oturan bir mandallanabilir kapağı olan ve kan dökülmelerini içerecek malzemeden yapılmış ikincil bir kapta taşındığından emin olun.
— Flebotomi servis prosedürü kılavuzu, numune dökülme potansiyeli olan hastanenin tüm alanları için (asansörler ve merdiven boşlukları gibi alanlar dahil) dökülme müdahalesi ve dökülme temizleme talimatlarını içermelidir.
— Laboratuvar tarafından istihdam edilen kurye hizmetlerinin, numunelerin taşınması için laboratuvar politikasını uyguladığından emin olun ve numune taşımacılığı ile ilgili personel eğitimi ve yetkinlik değerlendirmesinin belgelenmesini sağlayın (dökülme müdahalesi, temizleme ve olay raporlama prosedürleri dahil).
10.9.2. Laboratuvarda kirli ve temiz alanlar
Bkz. Bölüm 3.16.
10.9.3. Pnömatik boru sistemleri
Bkz. Bölüm 3.1.6.
10.9.4. Kişisel önlemler
Bkz. Bölüm 3.2.
10.9.5 Çalışma alanının dezenfekte edilmesi
Bkz. Bölüm 3.4.1.
Yöntem ne olursa olsun, dekontaminasyonun amacı flebotomisti, hastayı ve çevreyi ve bir hasta odasına/çizim istasyonuna giren veya hasta odasına/çizim istasyonuna giren veya dışına taşınan malzemeleri işleyen herkesi korumaktır.
- Bir hasta odasına getirilen flebotomi materyallerini sınırlayın.
- Hasta odası/çizim istasyonu çalışma alanını ayarlamadan önce ve tekrar hasta odasından ayrılmadan önce veya çizim istasyonu çalışma alanındaki her hastadan sonra çevre yüzeylerini rutin olarak temizleyin.
- Kullanılmış eldivenlerle dokunulan herhangi bir öğeyi (örn. kalem, telefon) dezenfekte edin.
- Yüzey alanlarını dezenfekte etmek için alkoller veya alkol bazlı çözeltiler kullanmayın, çünkü bunlar kolayca buharlaşır, bu da etkinliği önemli ölçüde azaltır. Bunun yerine, ev tipi çamaşır suyunun 1:10 seyreltilmesi veya hastane tarafından önerilen dezenfektan gibi sulu dezenfektanlar kullanın.
- Ev tipi çamaşır suyunun 1:10 seyreltilmesi veya hepatit B virüsüne, insan immün yetmezlik virüsüne ve diğer kanla bulaşan patojenlere karşı etkili olan diğer EPA tescilli dezenfektanların 1:10 seyreltilmesi gibi çevresel yüzeyler için önerilen dezenfektanları kullanın (205).
10.9.6. Hasta odası çalışma alanlarını ve çizim istasyonlarını dezenfekte etmek
Bkz. Bölüm 3.4.1.
- Prosedür kılavuzuna hangi KKD'nin kullanılacağı, nasıl temizleneceği, hangi dezenfektanın kullanılacağı ve malzemelerin nasıl atılacağı ile ilgili talimatları ekleyin. Referans için talimatları flebotomi ofisine gönderin.
- Nüfuz ve kolay çıkarılmaya izin vermek için kurutulmuş kan veya vücut sıvısının tüberkülosidal dezenfektanla en az 20 dakika temas etmesine izin verin.
- Yüzey alanlarından kurutulmuş kanı veya vücut sıvısını kazımak için asla bıçak veya başka bir alet kullanmayın çünkü bu aerosol üretebilir.
10.9.7. Flebotomide eğitim ve yetkinlik değerlendirmesinin belgelenmesi
Değerlendirme, hasta ortamlarında ve Standart Önlemler kavramında geçerli herhangi bir hastane enfeksiyon kontrol politikası/prosedürü hakkında bilgi ve bunlara bağlılık içerir.
11. Kan Bankası
11.1. Transfüzyonla Bulaşan Hastalıklar
Birçok bulaşıcı ajan enfekte kanın transfüzyonu yoluyla bulaşır; bunlar arasında hepatit B virüsü, hepatit C virüsü, insan immün yetmezlik virüsleri 1 ve 2, insan T-hücresi lenfotropik virüsler (HTLV-I ve II), sitomegalovirüs, parvovirüs B19, Batı Nil virüsü, dang virüsü, tripanozomiyazis, sıtma ve varyant Creutzfeldt-Jakob hastalığı bulunur. AABB, transfüzyonla bulaşan hastalıklar hakkında da bilgi sağlar: http://www.aabb.org/Pages/Homepage.aspx![]() .
.
11.2. Kanla Bulaşan Patojen Standardı
İş Güvenliği ve Sağlığı İdaresi'nin (OSHA) Kan Yoluyla Bulaşan Patojen Standardı, 29 CFR 1910.1030'a kan bankası laboratuvarında uyulmalıdır (33).
11.3. Numune Alma ve Oturum Açma/Kurulum İstasyonu
Numunelerin ve numune kaplarının taşınması için kılavuzlar Bölüm 3.1'de açıklanmıştır.
11.4. Açık Tezgahta Çalışın
Kan bankası için yazılı prosedürler, potansiyel maruziyetleri azaltmak için belirli iş uygulamalarını ve iş uygulaması kontrollerini içerir. Standart operasyonel prosedürler (SOP'ler) ve prosedür kılavuzları Bölüm 3.1.4'te açıklanmıştır.
11.4.1. Sabitlenmemiş numuneler
- Mikroskoplar
— Kullanımdan sonra veya laboratuvar tarafından belirlenen belirli bir programa göre aşamayı, göz merceklerini, düğmeleri ve diğer kirlenmiş parçaları dezenfekte edin.
— Mikroskopta aşındırıcı olmayacak uygun bir dezenfektan seçin (bkz. Bölüm 3.4.1). - Slayt hazırlıkları
— Mümkün olduğunda camı plastikle değiştirin.
— Havada slaytlar sallamaktan veya açık bir tezgahta elektrikli fanlar kullanmaktan kaçının ve kızakları kurutun.
— Slaytları kurutmak için başka aletler kullanılıyorsa, aerosol risklerini ölçmek için bir risk değerlendirmesi yaptırın. - Manuel hücre yıkama
Bir risk/tehlike değerlendirmesi yapın.
— Hücre süspansiyonlarının tuzlu yıkaması için, otomatik hücre yıkayıcılarının kullanılması, bu prosedürle ilişkili tehlikelerin bir kısmını azaltır, ancak hepsini azaltmaz.
— Tuzlu yıkamaları dökme kaplara boşaltmak sıçramalara ve aerosollere neden olabilir. Sıçrama, yarı otomatik pipetler kullanılarak ve dökme kaplardaki sıvı seviyelerini dörtte birinin altında tutarak en aza indirilebilir. Sıçramalardan korumak için sabit kalkanlar veya uygun suya dayanıklı kişisel koruyucu ekipman (PPE) giyin.
— Kırmızı hücre peletlerini yeniden askıya almak ve uç nokta aglütinasyonunu okumak için küçük test tüplerini çalkalarken, sabit tezgah üstü kalkanlar kullanın veya sıçramalardan ve spreylerden korumak için uygun KKD giyin. - Spreylerden ve kan/bileşen torbalarının olası patlamasından korumak için uygun yüz ve göz korumasına sahip bir plazma çıkarıcı veya ekspresör kullanarak prosedürler gerçekleştirin.
- Doğrulayıcı testler veya diğer testler sırasında donör segmentlerini keserken uygun yüz ve göz koruması kullanın.
- Kan torbalarının ve bileşenlerin dış yüzeylerini, infüzyon için serbest bırakılmadan önce uygun dezenfektanla nemlendirilmiş bir havluyla silin, dezenfektanın plastik torbaya zarar vermemesini sağlayın.
- Kan bankası tezgahlarında sıçramaları veya spreyleri önlemek için mühendislik kontrolleri mevcutsa, KKD gereksinimi, sıçramalara veya spreylere maruz kalmayı önlemek için mühendislik kontrolünün etkinliğinin bir değerlendirmesi ve kanıtı temelinde değiştirilebilir.
11.4.2. Biyolojik güvenlik kabini
Tüm aerosol üreten işlemler için Sınıf II biyolojik güvenlik kabini (BSC; bkz. Bölüm 3.3) gereklidir.
11.4.3. Kişisel koruyucu ekipman
Bkz. Bölüm 3.2.2.
11.4.4. Dezenfeksiyon
Bkz. Bölüm 3.4.
11.4.5. Laboratuvar atıklarının dekontaminasyonu ve bertarafı
Bir atık yönetimi planı da dahil olmak üzere tartışma için Bölüm 3.5'e bakın.
11.5. Laboratuvarın Temiz ve Kirli Alanları
Bkz. Bölüm 3.16.
11.6. Enstrümantasyon
Bkz. Bölüm 3.17.
11.6.1. Buzdolapları ve dondurucular
Kan bankasındaki tüm buzdolapları ve dondurucular için, kontaminasyonu en aza indirecek ve ekipmanın ömrünü uzatacak bir temizlik ve bakım protokolü oluşturun ve ayrıca gerektiğinde kan bankası buzdolaplarının düzgün ve hızlı sıcaklık geri kazanımı sağlamak için ihtiyaç duyduğu gelişmiş soğutma sistemlerini sürdürün. (ayrıca bkz. Bölüm 3) Çoğu yeni kan bankası laboratuvarı buzdolapları ve dondurucuları paslanmaz çeliktir ve temizlik ve saniteni daha kolay bir süreç haline getiren boyalı yüzeylere ve çıkarılabilir tepsilere sahiptir.
- Kan bankası buzdolapları ve dondurucuların kullanımı ve bakımı için üretici talimatları genellikle önerilen KKD ve dezenfektan türünü içerir.
- Ekipmanla ilgili talimatlar sağlanmazsa, temizlik ve bakım için SOP'lar oluşturmak üzere üretici ile işbirliği yapın.
- Dökülen kanları hemen temizleyin.
- Her vardiyanın sonunda buzdolabı kollarını ve kulpların etrafındaki dış kapıları temizleyin.
- Buzdolabını evrensel biyolojik tehlike sembolü ve "Biohangezard" kelimesiyle etiketleyin.
11.6.2. Otomatik kan bankası analizörleri
Artık donör toplama ayarlarına veya hasta transfüzyon ayarlarına uyarlanmış otomatik veya yarı otomatik cihazlar mevcuttur. Bu araçlar, kan bankalarında ve donör toplama ortamlarında açık tezgah testlerinin çoğunu değiştirme potansiyeline sahip olsa da, bazı antikor tespit ve doğrulama prosedürleri ve daha küçük laboratuvarlarda manuel testler hala kullanılmaktadır. Şu anda Amerika Birleşik Devletleri'nde kullanım için onaylanmış tüm kan bankası otomatik analizörleri, operatör maruziyetlerini azaltmaya yardımcı olacak özellikler ekledi, ancak maruz kalma potansiyelini tamamen ortadan kaldırmadı.
- Hızlı hareket eden veya hızlı sıvı veren örnek problar aerosoller ve damlacıklar oluşturabilir.
- Aletlerin üretici talimatlarına göre kullanıldığından emin olun.
- Kullanım sırasında cihaz güvenlik kalkanlarının ve muhafaza cihazlarının yerinde olduğundan emin olun.
- Numune probları ve sıvı seviyesi sensörleri yakınında el hareketi miktarını sınırlayın.
- Operatörün numune problarını silmesi gereken aletleri kullanırken eldiven giyin ve bir tarafında geçirimsiz plastik kaplamalı gazlı bezler kullanın.
- Numune tepsilerini, numune kartlarını ve numune plakalarını dikkatli bir şekilde tutun ve dökülmeyi önlemek için numune alınmadığında örtün.
- Mekanik cihazlar kullanarak aliquot tüplerini doldurun ve asla dekak (dökün).
- Klinik analizör atıklarının kontamine olduğunu düşünün ve eyalet ve yerel düzenlemelere uygun olarak atın.
- Uygun KKD ve kullanılacak temizleme çözeltisinin türü de dahil olmak üzere, bir cihazın üzerine veya içindeki numune dökülmelerinin rutin temizliği ve sorun giderilmesi için üretici talimatlarını izleyin.
- Üretici talimatları dökülme önleme ve temizleme talimatlarını içermediğinde, operatörü etkili bir şekilde koruyacak ve cihazın çalışma ömrünü koruyacak ve uzatacak bir SOP geliştirmek için cihaz üreticisiyle işbirliği yapın.
11.6.3. Toplam veya yarı otomatik test sistemleri
Bkz. Bölüm 10.6.6.
11.7. Test Kitleri ve Reaktif Tepsileri
Bkz. Bölüm 10.7.
11.8. Donör Kan Toplama, Aferez ve Eğilim
Donör toplama ve aferez alanları hasta bakım ayarları olarak kabul edilir ve tüm geçerli hastane hasta bakımı ve enfeksiyon kontrol politikalarına/prosedürlerine kesinlikle uyulmalıdır.
- Bulaşıcı hastalık testlerinin kalitesini ve toplanan tüm kan ve kan ürünlerinin güvenli bir şekilde elden çıkarılmasını ve taşınmasını kontrol etmek için süreçler ve prosedürler oluşturun ve sürdürün.
- Standart Önlemleri Kullanın.
- Ek KKD'nin ne zaman veya ne zaman uygun olabileceğini belirlemek için risk ve tehlike değerlendirmelerini kullanın.
- Herhangi bir ek numunedeki kapak/kapakların taşımadan önce sıkıca sabitlendiğinden emin olun.
- Toplama bölgesinden başka bir yere taşınan kan veya kan ürünlerini, belirli bir sıcaklık aralığını korumanın yanı sıra, sıkı bir örtüye sahip olan ve kan dökülmelerini içerecek malzemeden yapılmış ikincil bir kapta yerleştirin.
- Özellikle çevresel koşullar yırtılmaya neden olabileceği durumlarda (örneğin, pnömatik tüp sistemleri) dökülmeleri içerecek şekilde transfüzyon için verilen tek donörlü üniteleri veya bileşenleri ikincil bir kap içine yerleştirin.
- Klinik bakım için kabul edilebilir ve yaralanmalara karşı optimum koruma sağlayan tasarlanmış kesici yaralanma önleme cihazlarını seçin ve kullanın. Ponksiyon ve kesikleri önleme tartışması için Bölüm 3.14.1'e bakın.
- Keskin ara yaralanma önleme cihazlarının kullanım ve seçiminin yıllık değerlendirmesini sağlamak için bir süreç oluşturun (196).
- Keskin artı imha kaplarına kolay erişim sağlayın; asla dörtte üçünden fazlasını doldurmayın; ve bunları keskin alet yaralanma önleme cihazlarının yıllık değerlendirmesine, seçimine ve kullanımına dahil edin.
- Donör kanını ve bileşenlerini hasta numuneleri ve reaktif tepsileri ile birlikte saklamayın.
- Laboratuvar personelinin eğitimini belgelemek ve yeterliliklerini değerlendirmek. Hasta ortamlarında hastane enfeksiyon kontrol politikaları/prosedürleri ve Standart Önlemler kavramı hakkında bilgi ve bunlara bağlılığı tüm belgelenmiş eğitimlere dahil edin.
- Federal, eyalet ve yerel düzenlemelere uygun olarak modası geçmiş kanı, kan bileşenlerini ve dokuyu atın.
12. Veteriner Teşhis Laboratuvarı
12.1. Giriş
Bu bölüm, veteriner teşhis örneklerinden biyogüvenlik tehlikelerini en aza indiren iş uygulamaları için pratik kılavuzlar sunmaktadır. İnsan klinik mikrobiyoloji laboratuvarları için biyogüvenlik uygulama kılavuzlarının çoğu veteriner teşhis laboratuvarlarında uygulanabilir. İnsan klinik mikrobiyoloji laboratuvarlarına benzer şekilde, veteriner teşhis laboratuvarlarında yapılan çalışmaların niteliği, bu laboratuvarcıları da laboratuvar kaynaklı enfeksiyonlar için risk altına sokar. İnsanlarda bulaşıcı hastalıkların yüzde altmışı, tür çizgileri arasında hareket eden çok konaklı patojenlerden (206,207) kaynaklanmaktadır ve son 30 yıl boyunca, ortaya çıkan insan patojen hastalıklarının %75'i (örneğin, Batı Nil virüsü ateşi, yüksek patojenik kuş gribi, Lyme hastalığı) zoonotik, yani insanlar ve hayvanlar arasında bulaşmıştır (208). İnsan olmayan tüm teşhis örnekleri, insanlar için potansiyel olarak bulaşıcıdır, ancak risk derecesi, insan teşhis örneklerinin işlenmesi ve incelenmesinden daha azdır. İnsan tanısal örneklerdeki potansiyel bulaşıcı ajanlar, tanım gereği insan patojenleridir. Tersine, hayvan tanı örneklerindeki tüm potansiyel enfeksiyöz ajanlar insan patojeni değildir. Veteriner teşhis laboratuvarlarında biyogüvenlik riskini yönetmenin anahtarı sadece iyi genel biyogüvenlik uygulamalarına değil, daha da önemlisi "bilinmeyen" tanı numunesinin pratik bir risk değerlendirmesine de bağlıdır.
Genel olarak, veteriner teşhis laboratuvarları, genel veteriner teşhis çalışmaları için biyogüvenlik seviyesi (BSL)-2 uygulamalarını ve tesislerini kullanır ve azaltılmış (BSL-1) veya artan (BSL-3) biyogüvenlik uygulamalarının veya tesislerinin garanti edilip edilmediğini belirlemek için gelen katılımların pratik risk değerlendirmesini yapar. Biyogüvenlik riski ve uygulamaları, insan ve hayvan tanı örneklerinin kullanımı arasında farklılık gösterdiğinde, bu farklılıklar bu bölümde vurgulanmıştır.
12.2. Biyolojik Risk Sınıflandırması ve Değerlendirmesi
12.2.1. Risk sınıflandırması
Çeşitli mikroplardan kaynaklanan risk değerlendirmesini kolaylaştırmak ve bu mikropların kullanımı için uygun güvenlik uygulamalarını önermek için risk gruplarının iki sınıflandırması geliştirilmiştir (1). Dünya Hayvan Sağlığı Örgütü (OIE) ve Dünya Sağlık Örgütü (WHO), risk düzeyine ve etkili tedavi ve önlemenin mevcudiyetine bağlı olarak insanlar ve hayvanlar için dört grup biyo-tehlikeli ajan listeler (Tablo 12) (209). CDC/Ulusal Sağlık Enstitüleri (CDC/NIH) kılavuzları, laboratuvardan edinilen enfeksiyonlara neden olduğu bilinen ajanlar için uygun çevreleme uygulamaları için dört biyogüvenlik seviyesi ve öneri önermektedir (Tablolar 12,13) (1). İki risk grubu listesi kabaca eşdeğerdir ve ikisi de zayıf bir bağışıklık sistemi veya hamilelik gibi önceden var olan koşullar nedeniyle enfeksiyonlara karşı özellikle duyarlı olan kişilere izin vermez. Her iki risk grubu sınıflandırma sisteminde, artan risk seviyeleri (sayılar), bir ajana maruz kalmaktan kaynaklanan mesleki riskin artması ve bu ajanla çalışmak için ek çevreleme ihtiyacı anlamına gelir.
- Genel olarak, rutin veteriner teşhis laboratuvarlarında çalışmak, bir risk değerlendirmesi aksini göstermedikçe, klinik örneklerin grup 2 ajan içerdiğini ve BSL-2 uygulamalarıyla çalıştığını varsayar. Bazen, veteriner tanı laboratuvarları grup 3 ajanlarla karşılaşabilir ve BSL-3 uygulamalarını kullanabilir. Sadece olağanüstü koşullar altında veteriner tanı örnekleri risk grubu 4 ajan içerecektir; bunlar buraya dahil değildir. Veteriner tanı laboratuvarlarında yaygın olarak karşılaşılan risk grubu 2 ve grup 3 ajan örnekleri listelenmiştir (Kutu 2).
- Zoonotik ajanlara ek olarak, veteriner teşhis laboratuvarları risk değerlendirmesi sırasında "yüksek sonuçlu hayvan patojenlerinin" şüpheli varlığını değerlendirmelidir. Yüksek sonuçlu hayvancılık patojenleri ABD tarafından tanımlanmaktadır. Tarım Bakanlığı (USDA), Hayvan ve Bitki Sağlığı Denetim Servisi (APHIS) 2008 yılında ABD'de yayınlanan seçili ajan ve toksin düzenlemelerine uygun olarak Tarımsal Seçme Ajan programı. ABD tarafından Federal Kayıt Sağlık ve İnsan Hizmetleri Bakanlığı (42 CFS bölüm 73) ve USDA (9 CFS bölüm 121 ve 7 CFS bölüm 331) (40). Yüksek sonuçlu hayvan patojenlerini sınıflandırmak için kullanılan kriterler, hayvansal ürünler üzerindeki etkinin şiddeti, ajanın virülansı ve bulaşabilirliği ve etkili tedavinin mevcudiyetini içeriyordu. Mutlaka zoonotik ajanlar olmasa da, yüksek-sonuçlu hayvancılık patojenleri, tarımsal hayvan sağlığı üzerinde ciddi zararlı ekonomik etkiye sahip olabilir ve çevresel dağılmayı ve kontaminasyonu önlemek için BSL-3 uygulamalarını ve tesislerini kullanarak kullanım gerektirir (Kutu 3).
12.2.2. Risk değerlendirmesi
Ayrıntılı risk değerlendirme kılavuzları için Bölüm 2'ye bakın.
- Bir risk değerlendirmesi yapmak için resmi bir standart yaklaşım, yöntem veya doğru bir yol yoktur, ancak bir risk önceliklendirme matrisi kullanmak, bir iş tehlikesi analizi yapmak veya bir prosedür, görev veya faaliyet yürütürken neyin yanlış gidebileceğine dair potansiyel senaryoları listelemek gibi çeşitli stratejiler mevcuttur. Veteriner tanı laboratuvarlarında risk değerlendirmesi, bilinmeyen klinik numunelerde çeşitli risk grubu veya BSL mikroorganizmalarının bulunma olasılığını ve ayrıca klinik numunelerin rutin olarak işlenmesinin laboratuvar çalışanlarını bu numunelerdeki bulaşıcı ajanlara maruz bırakma olasılığını dikkate alır. Bir risk değerlendirmesi, klinik numunenin kaynağını (konak türler ve klinik öykü dahil), doğal risk grubu özelliklerine sahip bir numune içindeki şüpheli patojeni, laboratuvardaki klinik numunenin tanısal çalışması sırasındaki iş aktivitesini ve laboratuvar personelinin yetkinliklerini ve deneyimini dikkate alacaktır.
- Veteriner teşhis laboratuvarları için en kritik risk değerlendirmeleri, konakçı türlerin, hastanın bilinen tıbbi durumu ve klinik öyküsünün, hastanın klinik belirtilerinin ve endemik yerel coğrafi koşulların dikkate alınmasıdır. (Birçok laboratuvar geniş ve çeşitli coğrafi bölgelerden örnekler alır.)
- Bazı risk grubu 3 ajanları, belirli coğrafi bölgelere veya belirli türlere ve klinik sendromlara endemiktir ve BSL uygulamalarının uygun seviyelere çıkarılmasını gerektirir. Örnekler arasında Amerika Birleşik Devletleri'nin batısındaki batı gri sincaplarında ani ölüme neden olan tularemi, kuzey orta Amerika Birleşik Devletleri'ndeki sığırlarda ani ölüme neden olan şarbon, büyükbaş hayvan kürtajlarına neden olan Coxiella burnetii ve kuş kafesi kuşlarında solunum veya enterik hastalığa neden olan psittacosis sayılır. Alternatif olarak, risk değerlendirmesi, rutin BSL-2 uygulamalarından biyogüvenlik uygulamalarında bir azalma olduğunu gösterebilir. Bir örnek, serolojik analiz için sunulan hayvan kan örnekleri olabilir. İnsan immün yetmezlik virüsü veya hepatit virüsü gibi kanla bulaşan insan patojenlerini barındırabilen insan kan örneklerinin aksine, hayvan serumu genel olarak zoonotik kanla bulaşan patojenler içermez ve genellikle bir risk değerlendirmesine dayanarak BSL-1 uygulamaları kullanılarak ele alınabilir.
- Bir laboratuvar katılım/gönderim formunda sağlanan klinik öykü ve diğer verilerin değerlendirilmesi, profesyonel yargıya bağlıdır ve zoonotik ve seçkin ajanlara (Kutular 2,3) ve bu ajanların neden olduğu hastalıklara aşina nitelikli bir veteriner tarafından yürütülecek veya denetlenecektir. Vaka katılımı ve oturum açma sırasında katılım evraklarından açıklığa kavuşturulamayan sorular ortaya çıkarsa, telefonla gönderen veteriner hekimle iletişime geçin. Tipik klinik bulgular, konakçı aralığı, temel epidemiyoloji ve bu ajanların neden olduğu hastalıkların coğrafi dağılımı hakkında bilgi esastır.
- Veteriner tanı örnekleri için biyogüvenlik risk değerlendirmesi kritiktir, çünkü veteriner teşhis örneklerinde insanlar için patojenik potansiyel, insan örneklerindekinden farklıdır.
12.3. Genel Biyogüvenlik Kılavuzları
Bir veteriner tanı laboratuvarındaki tüm alt disiplin alanlarına genel olarak uygulanabilen kapsamlı ve ayrıntılı biyogüvenlik kılavuzları için Bölüm 3'e bakın.
- Maruz kalma ve laboratuvardan edinilen enfeksiyon riski en yüksek olan kişi, teşhis numunesi içinde şüpheli bir bulaşıcı ajanı tanımlamak için çalışan laboratuvar görevlisidir; bu nedenle, kişisel maruziyeti önlemek için laboratuvar çalışma uygulamalarının seçimi, bir laboratuvar biyogüvenlik planı tasarlamada en önemli kararlardan biridir.
- Laboratuvarda, maruz kalma yolları sınırlıdır ve hava yoluyla ince damlacıklı bulaşıcı aerosollerin hava yoluyla solunmasını, cilt veya mukoza zarlarında doğrudan teması veya büyük damlacıklı bulaşıcı materyalin yutulmasını veya iğneler veya diğer keskinlerle perkütan bulaşmayı içerir (Tablo 1). 1989'da Laboratuvardaki Tehlikeli Biyolojik Maddeler Ulusal Araştırma Konseyi Komitesi, en yaygın laboratuvar enfeksiyonu yolları aracılığıyla bulaşıcı ajanlara maruz kalmamak için yedi temel ihtiyatlı biyogüvenlik uygulaması önerdi (210). Bu uygulamalar, en önemli olarak tanımlanmasına rağmen, bir biyogüvenlik tehlikesine maruz kalma riski veya bir BSL-3 ajanına maruz kalma olasılığı olduğunda ek uygulamalar, ekipman ve tesis tasarımı ile desteklenmelidir.
12.3.1. El yıkama
- El yıkama, bulaşıcı bir ajana maruz kalma süresini azaltmak ve bulaşıcı ajanın yayılmasını önlemek için en önemli prosedürdür. El kontaminasyonu, numunelerin manipülasyonu ve çalışma yüzeyleri, telefonlar ve ekipmanlarla temas sırasında meydana gelir.
- Laboratuvar personeli ellerini yıkamalı
— eldivenleri çıkardıktan hemen sonra
— bariz kontaminasyondan sonra;
- işin tamamlanmasından sonra;
- laboratuvardan ayrılmadan önce; ve
— sağlam olmayan cilt, gözler veya mukoza zarları ile el temasından önce.
12.3.2. Kişisel Koruyucu Ekipman
- Veteriner teşhis ve klinik laboratuvarlarında rutin çalışmalar için kişisel koruyucu ekipman (PPE) laboratuvar çalışma alanında sağlanmalı, kullanılmalı ve muhafaza edilmelidir. Laboratuvar çalışanlarını belirli görevler için KKD kullanımı konusunda eğitmek ve KKD'nin sınırlamalarını ve KKD'nin bakımı ve elden çıkarılması için uygun prosedürleri bilmek. Rutin veteriner tanı laboratuvarı çalışmalarında KKD kullanım düzeyi, şüphelenilen veya tanımlanan riske uygun BSL uygulamaları için yeterli olmalı ve en azından eldiven ve koruyucu giysiler içermelidir.
- Eldivenler, kullanıcıyı potansiyel olarak bulaşıcı malzemeye maruz kalmaktan korur ve genellikle ince lateks, vinil veya nitrildir. Sık sık değiştirilecekler. Koruyucu giysiler, tezgah seviyesinin altına uzanan tamamen kapatılabilir uzun kollu paltolar veya önlükler içerir. Çıplak ciltte kazara dökülmeyi önlemek için burunlu açık ayakkabılar laboratuvarda giyilmemelidir. Laboratuvar dışında koruyucu giysi giymeyin veya temizlik veya yıkama için eve götürmeyin.
- Laboratuvar temizliği de dahil olmak üzere laboratuvar işlemleri sırasında potansiyel olarak bulaşıcı materyal sıçramaları veya spreyleri oluştuğunda yüz ve göz koruması kullanın. Yüz ve göz koruma ekipmanı, sıçrama gözlükleri, yüz siperleri veya tezgah üstü sıçrama koruyucularını içerebilir.
- Risk değerlendirmesi, potansiyel olarak bulaşıcı aerosollerin solunmasını önlemek için uygun BSL uygulamalarını gösteriyorsa, solunum koruma cihazları (solunum cihazları) kullanın. Laboratuvarda solunum cihazı kullanma kararı, klinik bir örnekteki potansiyel bulaşıcı ajanların doğal riskinden (örneğin, BSL-3 veya risk grubu 3 ajanları) veya bulaşıcı aerosoller üretebilecek ajan tanımlama için gerekli laboratuvar manipülasyonlarından gelebilir. Solunum korumasının türü spesifik tehlikeye bağlıdır. N95 veya daha yüksek dereceli bir solunum cihazı kullanılamıyorsa (örneğin, sakal veya astım nedeniyle), solunum koruması gerektiğinde güçlü bir hava temizleyici (PAPR) takın. Cerrahi maskeler etkili solunum koruması değildir.
12.3.3. Personel eğitimi
- Biyogüvenlik eğitimi ve işçilerin potansiyel tehlikeler ve güvenli iş uygulamaları hakkında eğitimi, güvenli bir çalışma ortamı yaratmak için esastır. Güvenlik eğitim programının boyutu ihtiyaçlara göre değişecektir, ancak şunları içermelidir
— Standart Önlemler;
— KKD'nin seçimi, kullanımı ve sınırlamaları;
— biyolojik olarak tehlikeli atıkların yönetimi;
- maruz kalma sonrası yönetim, olayların raporlanması ve araştırılması;
— kan yoluyla bulaşan patojen bilgisi;
— risk gruplarının temel anlayışı ve risk değerlendirmesi; ve
— biyolojik olarak tehlikeli dökülmeler için prosedürler. - Biyogüvenlik eğitimini (eğitim tarihi ve içeriği) çalışanın eğitim kaydında belgeleyin ve kaydı 3 yıl boyunca tutun. Laboratuvar güvenlik eğitiminin etkinliğini periyodik olarak değerlendirin. Güvenlik değerlendirmeleri, güvenlik denetimlerini, dış kurumlar tarafından yapılan denetimleri, olay raporlarının gözden geçirilmesini ve çalışanlar tarafından yapılan gözlem ve önerileri içerebilir. Yönetim, güvenlik eksikliklerini gidermek ve düzeltmek için kaynaklar sağlasa da, tezgah üstünde çalışan laboratuvarcıların çabaları güvenli bir çalışma ortamının temelini sağlar.
12.3.4. Biyolojik dökülme yönetimi
- Klinik laboratuvarlarda biyolojik dökülmelerin yönetimi, spesifik bulaşıcı ajanı (biliniyorsa), dökülen bulaşıcı materyalin hacmini ve aerosollerin varlığını hesaba katmalıdır. Aerosoller, BSL-3 veya risk grubu 3 ajanlarını içeren dökülmelerde kolayca bulaşabilir. Bu nedenle, yolcular alanları derhal tahliye etmeli, kapıları kapatmalı ve alana 30–60 dakika tekrar girmemelidir.
- Biyolojik dökülmeler için KKD, delinmeye dayanıklı eldivenler, N95 solunum cihazları (BSL-2 veya 3), sıvı aşılmaz ayakkabı kılıfları, paltolar veya önlükler ve yüz koruması içerir.
- BSL-3 ajanları için bir solunum cihazı veya HEPA filtreli solunum cihazı kullanın. Diğer bir seçenek de belirlenmiş bir sızıntı acil müdahale ekibini aramaktır. Kırık camları dökülme alanında çıkarın ve ellerle temas etmeden atın (örneğin süpürge, forseps, maşa kullanın). Olası bir aerosolü içeren tipik bir biyolojik dökülme temizleme prosedürü aşağıdakileri içermelidir:
— Bölgedeki personeli uyarın ve tahliye edin.
— Kapıları kapatın ve hava değişimlerinin sayısına bağlı olarak 30-60 dakika boyunca alana tekrar girmeyin (bölgeye girişi yasaklayan işaret sonrası).
— Laboratuvar süpervizörü uyarısı.
— Dökülme türü için uygun KKD don.
— Kırık camı veya diğer nesneleri çıkarın ve atın (ellerle temas etmeden).
— Dökülmeyi emici malzeme ile emin.
— Kirlenmiş malzemeyi biyolojik olarak tehlikeli bir atık kabına atın.
— Sulu deterjanla temiz dökülme bölgesi.
— Alanı uygun dezenfektanla dekontamine edin.
— Dökülen bölgeyi suyla durulayın ve sahanın kurumasını bekleyin.
— Kirlenmiş laboratuvar formlarını kopyalayın ve biyolojik tehlike atık kabına atın.
— Tüm tek kullanımlık kontamine temizleme malzemelerini biyolojik tehlike torbasına koyun ve bulaşıcı atık olarak tedavi edin.
— Ellerinizi yıkayın.
— Bir dökülme/olay raporu hazırlayın, dökülme nedenini belirleyin ve düzeltici eylemi belirleyin. - Biyolojik bir güvenlik kabininde (BSC) bir dökülme meydana gelirse, kabin fanını kapatmayın. Bir BSC'deki küçük dökülmeler emici kağıtla emilebilir. Bulaşıcı malzeme ızgaraya akarsa, kabindeki tüm eşyaları dezenfektanla silin ve çıkarın. Tahliye vanasını kapatın ve yüzeye ve ızgaradan drenaj kabına dezenfektan dökün. Uygun temas süresine izin verin, ardından süzün, durulayın ve kurulayın.
- Bir santrifüjde (doğal olarak aerosol üretecek) kırılma meydana geldiğinde, dekontaminasyon başlamadan önce santrifüjü 30 dakika sıkıca kapalı tutun.
- Bir santrifüjdeki plastik vidalı kapaklı teneke kutunun içinde bir numune tüpü kırılırsa:
— Motoru kapatın.
— Teneke kutuyu hemen çıkarın ve bir BSC'ye yerleştirin.
— Sorumlu kıdemli kişiyi ve bölgede çalışan diğer meslektaşları bilgilendirin.
— Koruyucu giysi giyerken, güvenlik kabininin altındaki teneke kutuyu açın.
— Tüm yüzeyleri dekontamine etmek için teneke kutuya 1:10 seyreltilik bir çamaşır suyu veya aşındırıcı olmayan bir dezenfektan dökün. Teneke kutuyu çamaşır suyu veya dezenfektan solüsyonunda 10 dakika bekletin. Teneke kutuyu iyice temizleyin.
— Eldivenli ellerle kırık camları almayın. Forseps veya maşa veya hemostatlarda tutulan forseps veya pamuk kullanın ve bir biyogüvenlik kesici kabına atın.
— Biyolojik tehlike atıklarının bertarafı için teneke kutudan keskin olmayan tüm kirlenmiş malzemeleri kırmızı bir biyolojik tehlike torbasına atın.
— Kırılmamış kapaklı tüpleri aynı dezenfektanla temizleyin; sonra tekrar temizleyin, suyla yıkayın ve kurulayın.
— Temizleme sırasında kullanılan tüm malzemeleri bulaşıcı atık olarak ele alın.
Not: Numune tüpü, bireysel teneke kutuları olmayan ancak biyolojik tehlike kapağı ve sızdırmaz rotoru olan bir santrifüjde kırılırsa, temizleme ve dekontaminasyon için üreticinin talimatlarını izleyin.
12.3.5. Bağışıklama
- Bağışıklama Uygulamaları Danışma Komitesi, sağlık personelinin tüm yetişkinler için önerilen aşılarla (grip, kızamık/kabakulak/kızamıkçık, suçiçeği ve tetanoz/difteri/boğmaca) bağışıklanmasını tavsiye etmenin yanı sıra, mesleki maruz kalma riski taşıyanlar için meningokok veya hepatit B aşısını önermektedir (211). Bu ajanlar hayvan tanı örneklerinde mevcut değildir. Veteriner tanı laboratuvarlarında, laboratuvarların potansiyel risk grubu 3 veya BSL-3 patojenlerine karşı rutin olarak aşılanması önerilmemektedir. Bağışıklamanın dikkate alınması gereken tek durum, potansiyel olarak kuduz virüsü içeren çok sayıda örneği işleyen laboratuvarlar için kuduza karşıdır (örneğin, kuduzla uyumlu nörolojik hastalığı olan hayvanlardan merkezi sinir dokularını rutin olarak işlemek) (Tablo 14) (212).
12.4. Patoloji (Nekropsi ve Cerrahi Patoloji)
Bir veteriner tanı laboratuvarındaki nekropsi, cerrahi patoloji ve histoloji çalışma alanlarına uygulanabilir ayrıntılı biyogüvenlik kılavuzları için Bölüm 5'e bakın.
12.5. Parazitoloji
Bkz. Bölüm 6.
12.6. Mikoloji
Bkz. Bölüm 7.
12.7. Viroloji
Bkz. Bölüm 8.
12.8. Toksikoloji
Bkz. Bölüm 9.
12.9. Hematoloji/Seroloji
Bkz. Bölüm 10.
12.10. Moleküler Teşhis ve Hızlı Testler
Moleküler tanı testi (yani, polimeraz zincir reaksiyonu [PCR]) yapılırken veya enzime bağlı immünosorbent testi (ELISA) gibi hızlı testler kullanılırken izlenecek biyogüvenlik kılavuzları, yürütülen belirli teste özgü olabilir. Bunlar, belirli patojen ve test türlerini ele alan Bölüm 3 ve Bölüm 4, 5, 6, 7, 8 ve 10'da tartışılmıştır. Bölüm 8.10, moleküler tanı testleri için en kapsamlı biyogüvenlik kılavuzlarını sağlar.
12.11. Depolama, Paketleme ve Nakliye
Enfeksiyöz veya tanısal numunelerin depolanması, paketlenmesi ve nakliyesi ile ilgili bir veteriner teşhis laboratuvarındaki işlevler için geçerli ayrıntılı biyogüvenlik yönergeleri için Bölüm 13'e bakın.
12.12. Biyogüvenlik Eğitimi/Eğitimi
Bir veteriner tanı laboratuvarında biyogüvenlik eğitimi ile ilgili pratik kılavuzlar için Bölüm 15'e bakın.
12.13. Biyogüvenlik Kalite İyileştirmesi
Bir veteriner tanı laboratuvarında biyogüvenliğin sürekli iyileştirilmesine ilişkin kılavuzlar için Bölüm 16'ya bakın.
13. Bulaşıcı Maddelerin Depolanması, Paketlenmesi ve Nakliyesi
13.1. Bulaşıcı Maddelerin Depolanması
Bir klinik mikrobiyoloji laboratuvarında bulaşıcı maddelere taze ve işlenmiş hasta örnekleri, kültürler ve alt kültürler, depolanmış izolatlar ve serum veya plazma olarak karşılaşılır. Her zaman, bu maddelerin tümü zaman zaman bir şekilde ve bir süre uzun süre saklanmalıdır ve bu maddelerin çoğu laboratuvar çalışanları tarafından manipüle edilecek, yeniden yerleştirilecek ve başka bir şekilde dokunulacaktır. Bu nedenle, bulaşıcı maddelerin depolanması, klinik mikrobiyoloji laboratuvarlarında işçi güvenliğinin önemli ve ayrılmaz bir bileşenidir. Standart Önlemler ve aseptik tekniği kullanarak depolanan tüm bulaşıcı maddeleri kullanın. Depolama flakonunun harici kontaminasyonundan sorumlu organizmalar, depolama sırasında canlı kalacaktır ve flakonun manipüle edilmesiyle bulaşabilir.
- Sıkı oturan kapaklı birincil kaplar kullanın.
- Yaygın yürüyüş yollarından, laboratuvar arabasından, insan trafiğinden ve reaktiflerden mümkün olduğunca uzakta saklayın.
- Depolama alanına kısıtlı erişim sağlayın.
- Mikroorganizmaların canlılığını korumak için uygun sıcaklıklarda saklanmayı sağlayın.
- Öğenin dik kalmasını sağlayacak sağlam raflar, kovalar veya kutular kullanın.
- Saklama dolapları veya kilitli kapılı buzdolapları sağlayın.
- Uzun süreli kültür arşivlerini, alt kültürleri ve işlenmiş hasta örneklerini saklamak için ayrı buzdolapları kullanın.
13.2. Bulaşıcı Maddelerin Paketlenmesi ve Sevkiyesi
- Rutin ve özel testler için referans laboratuvarların kullanımı son yıllarda artmıştır. Bazı referans laboratuvarları, gönderen laboratuvardan numune toplamak için bir kurye gönderemeyebilir. Bu nedenle, ortak hava ve yer taşıyıcıları kullanarak numuneleri iletmek için gereken numune taşıma standartları ve gereksinimleri hakkında bilgi, teşhis laboratuvarları için giderek daha önemli hale gelmiştir.
- Amerikan Mikrobiyoloji Derneği, bulaşıcı maddelerin paketlenmesi ve nakliyesi için kapsamlı kılavuzlar yayınladı (213–215). Bunlar, Uluslararası Hava Taşımacılığı Birliği (IATA) ve ABD tarafından yayınlanan yönergelere dayanmaktadır. Ulaştırma Bakanlığı (DOT). Burada sunulan bilgiler, bu kılavuzların kısaltılmış bir versiyonudur ve bulaşıcı maddelerin paketlenmesi ve nakliyesi için her şey dahil bir kılavuz olması amaçlanmamıştır. Bu gerekliliklere ek olarak izinler gerekebilir.
Not: Bulaşıcı maddelerin taşınmasını düzenleyen gereklilikler ve düzenlemeler sık sık değişir. Nakliyeciler, bu değişikliklerin farkında olmaktan, mevcut düzenlemelere uymaktan, nakliyeden önce izin almaktan ve kendileri ve tesisleri için geçerli düzenlemeleri yorumlamaktan sorumludur. Bu maddeleri taşıyan kişilerin, ilgili uygun ajansların web sitelerini kontrol etmeleri tavsiye edilir.
13.2.1. Yönetim makamları ve düzenlemeleri
- Dünyada en çok tanınan ve kullanılan paketleme ve nakliye yönergeleri, yıllık IATA yayını Tehlikeli Mallar Yönetmeliği'ndeki (216) kılavuzlardır.
- Amerika Birleşik Devletleri'nde DOT, tehlikeli malların (örneğin patlayıcılar, gazlar, yanıcı sıvılar, bulaşıcı maddeler ve radyoaktif malzemeler) hem hava hem de yer taşıyıcıları tarafından ticari olarak taşınmasını düzenler (93). DOT düzenlemeleri IATA ile önemli bir anlaşma içindedir.
13.2.2. Düzenlemelerin önemi
Yönetmeliklerin amacı, halkı, acil durum müdahale ekiplerini, laboratuvar çalışanlarını ve ulaşım sektöründeki personeli, paketlerin bulaşıcı içeriklerine kazara maruz kalmaktan korumaktır. Bu düzenlemelere ve gerekliliklere uymanın güvenlikle ilgili olmayan önemli bir yararı, taşıma sırasında paketin içeriğine zarar verme olasılığını en aza indirmek ve nakliyecinin tehlikeli malların yanlış nakliyesiyle ilişkili cezai ve hukuki sorumluluğa maruz kalmasını azaltmaktır.
13.2.3. İstisnalar
- Kategori A dışı küçük miktarlarda bulaşıcı maddelerin (genellikle klinik, teşhis veya diğer hasta bakımı amacıyla taşınan örnekler; bkz. Bölüm 13.3), örnekler kurye ile, yani özel veya sözleşmeli taşıyıcı ile yalnızca bu tür maddeleri taşımak için kullanılan bir motorlu araçta taşınıyorsa çoğu DOT düzenlemesinden muaftır (93).
- DOT düzenlemelerine göre Kategori A olmayan bulaşıcı maddeleri araç içinde paketleyin ve sabitleyin.
- Bu DOT düzenlemeleri genellikle İş Güvenliği ve Sağlığı İdaresi (OSHA) düzenlemelerinden daha az katıdır ve maddelerin yalnızca sızdırmaz kaplarda olması, güvenli bir şekilde kapatılması ve taşıma sırasında araç içinde sabitlenmesi gerektiğini belirtir. Olağan OSHA düzenlemeleri, bulaşıcı maddelerin kurye taşımacılığı sırasında hala geçerlidir. Güncellemeler için DOT ve IATA web sitelerine bakın.
13.2.4. Özel düzenlemeler
- Bulaşıcı maddelerin güvenli ve yasal taşınması, aşağıdaki zorunlu faaliyetlere dayanmaktadır:
— sevkiyat için bulaşıcı maddeleri işleyen kişiler için her 2 (IATA) veya 3 (DOT) yılda bir eğitim;
— bulaşıcı maddelerin sınıflandırılması ve adlandırılması;
— doğru ambalaj malzemelerinin seçimi;
— gönderileri doğru şekilde paketlemek;
— dış ambalaja uygun işaretler ve etiketler yerleştirmek; ve
— her bir paketin ve içeriğinin ilgili yönlerini belgelemek.
13.2.5. ABD Posta Hizmeti
ABD Posta Servisi, USPS Yurtiçi Posta El Kitabında (96) kendi düzenlemelerini yayınlamaktadır. Tehlikeli maddelerin postalanmasına yönelik USPS düzenlemeleri genellikle DOT düzenlemelerine uygundur; ancak, özel ihtiyaçlar ve gereksinimler için USPS Yurtiçi Posta Kılavuzuna bakın.
13.3. Bulaşıcı Maddelerin Sınıflandırılması
13.3.1. Sınıflandırma
Sevk edilen tüm mallar, ticari taşıyıcılar tarafından sevk edilen tehlikeli malları tanımlamak için üç-step bir işlem kullanılarak sınıflandırılmalıdır. Sınıflandırma, gönderenin uygun IATA paketleme talimatlarını ve kullanma talimatlarını seçmesine olanak tanır ve madde Kategori A bulaşıcı bir madde ise, gerekli belgeleri (Tehlikeli Mallar için Gönderici Beyannamesi) tamamlamak için gerekli bilgileri sağlar.
13.3.2. Sınıflandırma adımları
- Malzeme, tehlikeli malların IATA tarafından belirtilen dokuz sınıfından (Sınıf 1'den Sınıf 9'a) birinde sınıflandırılır. Bulaşıcı ve toksik maddeler Sınıf 6 tehlikeli mallardır; kuru buz Sınıf 9 tehlikeli bir maldır. Sınıf 6 ve Sınıf 9 maddeler genellikle laboratuvarcılar tarafından sevk edilen tek tehlikeli mallardır.
- Sınıf 6 maddeler Bölüm 6.1 (toksik maddeler) veya Bölüm 6.2 (enfeksiyöz maddeler) olarak kategorize edilmelidir.
- Bölüm 6.2 bulaşıcı maddeler, IATA tarafından belirtilen dokuz bulaşıcı madde türünden birinde sınıflandırılmalıdır: Kategori A bulaşıcı madde, Kategori B bulaşıcı madde, hasta örnekleri, muaf insan veya hayvan örnekleri, genetiği değiştirilmiş organizmalar, muaf maddeler, biyolojik ürünler, enfekte hayvanlar veya tıbbi atıklar (Tablo 15).
- Maddenin bir "hasta örneği" veya bir "organizma" olduğu belirlenirse ve açıkça bir Kategori A veya Kategori B maddesi değilse, ancak bir Kategori A veya Kategori B maddesinin kriterlerini karşılıyorsa veya bir özelliklerine sahipse, nakliyeci bunu Kategori A veya Kategori B maddesi olarak sınıflandırmalıdır. Aksi takdirde, madde sırasıyla "muaf insan veya hayvan örneği" veya "genetik olarak değiştirilmiş bir organizma" (Sınıf 9) olarak sınıflandırılmalıdır.
13.3.3. Kategori A bulaşıcı maddeler
Kategori A maddesi, "maruz kaldığında, başka türlü sağlıklı insanlar veya hayvanlar için kalıcı sakatlığa veya yaşamı tehdit eden veya ölümcül hastalığa neden olabilecek bir biçimde taşınan bulaşıcı bir maddedir" (93).
- Kategori A maddeleri IATA ve DOT tarafından özel olarak belirlenmiş ve listelenmiştir. Kategori A maddelerinin listesi her şey dahil değildir; göndericinin IATA tarafından kapsamlı bir risk değerlendirmesi yapmasına ve bir maddenin Kategori A kriterlerini karşılayıp karşılamadığına karar verirken takdir yetkisi ve profesyonel yargı kullanmasına izin verilir. Kategori A maddelerine UN2814 veya UN2900 numarası verilmelidir (Şekil 2).
Not: Bazı Kategori A bulaşıcı maddeler, yalnızca madde kültür formunda, yani konsantre ise Kategori A olarak kabul edilir; bu ayrım spesifik IATA listesinde açıkça belirtilmiştir. - Bazı Kategori A patojenleri biyoterörizm ajanları olarak belirlenmiştir ve seçkin ajanlar olarak bilinir (40). Federal düzenlemeler, nakliyecilerin belirli acentelere sahip olma, kullanma, aktarma ve alma izinlerine sahip olmasını ve özel kayıtlara sahip olmasını gerektirir.
13.3.4. Kategori B bulaşıcı maddeler
Kategori B maddesi "Kategori A'ya dahil edilme kriterlerini karşılamayan bulaşıcı bir maddedir" (93). Kategori B maddeleri genellikle engelliliğe, yaşamı tehdit eden hastalığa veya ölümcül hastalığa neden olabilecek bir biçimde değildir. Kategori B maddelerine UN3373 (Biyolojik Madde, Kategori B) numarası UN numarası verilmelidir. Olası Kategori B maddelerinin örnekleri aşağıdadır:
- Tipik klinik, tanısal veya hasta örnekleri, örn. kan, biyopsiler, sürüntü örnekleri, dışkı, sekret, vücut sıvıları veya dokular (a) Kategori A olmayan bulaşıcı mikroorganizma(lar) için rutin kültürleme veya tarama testi için sevk ediliyor veya (b) Kategori A olmayan bir mikroorganizma(lar) içerdiğinden şüpheleniliyor;
- Klinik mikrobiyoloji laboratuvarlarında rutin olarak karşılaşılan ve manipüle edilen Kategori A dışı mikroorganizmaların tipik klinik laboratuvar kültürleri (genellikle katı veya sıvı ortamda) (Şekil 2).
13.3.5. Muaf insan (veya hayvan) örnekleri
Muaf insan veya hayvan vücut bölgesi örnekleri, "mevcut patojenlerin olma ihtimali minimum" olanlardır (93). Bu tür örneklere örnek olarak glikoz, kolesterol, hormon seviyeleri, prostata özgü antijen ve kalp ve böbrek fonksiyonunu değerlendirmek için kullanılan analitler için test edilecek idrar veya serum verilebilir.
- Numunenin bulaşıcı bir risk olup olmadığını veya patojenler içerip içermediğini belirlemek için profesyonel yargı ve hasta tıbbi geçmişi bilgisi kullanılabilir.
- Muaf insan veya hayvan numuneleri, Kategori A ve Kategori B maddelerine göre daha az katı paketleme gerekliliklerine sahiptir. IATA, muaf insan veya hayvan örneklerini içeren dış paketlerin açıkça "Muaf İnsan Örneği" veya "Muaf Hayvan Örneği" olarak etiketlenmesini gerektirir. DOT, dış ambalajlarda bu etiketi gerektirmez (Şekil 2).
13.3.6. Muaf maddeler
Klinik laboratuvarlarda yaygın olarak karşılaşılan birçok madde katı bulaşıcı madde sevkiyat gerekliliklerinden muaftır (Şekil 2). Bu tür maddelere örnekler
- Bulaşıcı maddeler içermeyen veya insanlarda ve hayvanlarda hastalığa neden olma olasılığı düşük olan maddeler;
- Çoğu çevresel numune (örn. gıda, toprak);
- Nötralize edilmiş veya inaktif mikroorganizmalar içeren maddeler;
- Alkol veya uyuşturucu için test edilecek maddeler, gebelik göstergeleri, kanser ve antikorlar;
- Adli analiz için gönderilen numuneler;
- Kurutulmuş kan lekeleri ve dışkı gizli kan tarama örnekleri;
- Transfüzyon veya nakil amacıyla toplanan kan ve kan bileşenleri;
- Gıda ve İlaç İdaresi (FDA) onaylı ve FDA lisanslı biyolojik ürünler; ve
- Formalin koruyucu olarak kullanıldığında birincil kap başına <30 mL %10 formalin.
13.3.7. Hasta örnekleri
- Bir "hasta örneği", teşhis, tedavi, önleme, araştırma veya araştırma amacıyla doğrudan insanlardan veya hayvanlardan toplanan materyaldir.
- Kategori A veya Kategori B kriterlerini karşılayan hasta örnekleri Kategori A veya Kategori B maddeleri olarak sınıflandırılmalıdır.
- Ne Kategori A ne de Kategori B kriterlerini karşılayan hasta örnekleri muaf insan veya hayvan örnekleri olarak ele alınmalıdır (Şekil 2).
13.3.8. Genetiği değiştirilmiş organizmalar
Genetiği değiştirilmiş organizmalar genellikle Kategori A veya Kategori B kriterlerini karşılar. Durum böyle değilse, organizma "genetiği değiştirilmiş bir mikroorganizma" (Sınıf 9, Çeşitli Tehlikeli Mallar) olarak sınıflandırılmalı ve bu şekilde paketlenmeli ve sevk edilmelidir.
13.3.9. Biyolojik ürünler
Neredeyse piyasada bulunan tüm biyolojik ürünler, bulaşıcı maddelerin ambalajlanması ve nakliyesi için düzenlemelerden muaftır. Biyolojik ürün örnekleri arasında bakteriyel tipleme serası, aşılar, bakteriyel antijenler, antimikrobiyal ajanlar, bakterileri tanımlamak için reaktifler ve antimikrobiyal duyarlılık testinde kullanılan reaktifler verilebilir.
13.3.10. Enfekte hayvan
- Enfeksiyöz bir madde içerdiği bilinen veya makul olarak beklenen canlı, kasıtlı olarak enfekte bir hayvan, madde başka herhangi bir yolla taşınamadığı sürece hava yoluyla taşınamaz. DOT'tan bir muafiyet gerekli olacaktır.
- Canlı veya ölü enfekte hayvanların gönderilmesi gerekiyorsa, bireysel ticari taşıyıcılarla istişare yapılması tavsiye edilir.
13.3.11. Tıbbi atık
- Kategori A veya Kategori B bulaşıcı maddeler içeren tıbbi atıklar, UN2814, UN2900 veya UN3373 numaralı olarak paketlenmeli ve sevk edilmelidir.
- Bulaşıcı madde içerme olasılığının düşük olduğuna makul bir şekilde inanılan tıbbi atıklar, "başka türlü belirtilmemiş tıbbi atık" (n.o.s) (UN3291) olarak paketlenmeli ve sevk edilmelidir.
13.4. Kategori A ve Kategori B Maddelerini Adlandırma
- Maddeyi sınıflandırdıktan sonra, gönderici, maddeye IATA Tehlikeli Mallar Yönetmeliği'nin mavi sayfalar bölümünde listelenen >3.000 IATA-belirtilmiş ve uluslararası kabul görmüş UN numaralarından ve uygun nakliye adlarından birini atayarak Kategori A ve Kategori B bulaşıcı maddeleri tanımlamalıdır (resmi olarak adlandırılmalıdır).
- Bu liste, uygun nakliye adlarının her biri için 14 bilgi öğesi sağlar; öğeler, Tehlikeli Mallar için Gönderici Beyanını tamamlamak için gereken bilgilere karşılık gelir. Neyse ki, çoğu klinik mikrobiyoloji laboratuvarı tarafından 3.000 uygun nakliye adından sadece yedisi kullanılmaktadır:
— İnsanları etkileyen Kategori A maddeleri için iki;
— Hayvanları etkileyen Kategori A bulaşıcı maddeler için iki;
— Kategori B bulaşıcı madde için bir tane;
— Genetiği değiştirilmiş organizmalar için bir tane;
— Biri kuru buz için. - Mavi sayfalar uygun nakliye adlarını, UN numaralarını, paketleme talimatlarını, miktar sınırlarını ve ambalaj ve nakliye maddeleriyle ilgili diğer bilgileri sağlar.
13.5 Ambalajlama Talimatları ve Ambalaj Maddeleri
13.5.1. Paketleme talimatları ve talimatları
- IATA paketleme talimatları (PI) bulaşıcı maddelerin güvenli taşınması için minimum standartları tanımlamaktadır.
- Klinik laboratuvarlar tarafından kullanılan talimatlar, Kategori A bulaşıcı maddelerin (PI 620), Kategori B bulaşıcı maddelerin (PI 650) ve kuru buzun (PI 954) nakliyesi ile ilgili talimatlardır.
- "Muaf insan veya hayvan örnekleri" olarak sınıflandırılan örnekler için özel olarak PI numaralı talimatlar yoktur; ancak IATA, izlenmesi gereken talimatları sağlar (Tablo 16).
13.5.2. Dış ambalajları işaretleme ve etiketleme
- Nakliyeciler, dış nakliye konteynerinin (yaygın olarak bir karton kutu) uygun şekilde işaretlenmesinden ve etiketlenmesinden sorumludur.
- İşaretler ve etiketler, ambalajın gönderen ve alıcısı, ambalajın içeriğinin niteliği ve ağırlığı, maddenin potansiyel tehlikesi, maddenin nasıl paketlendiği ve acil bir durumda kullanılacak bilgilerle ilgili temel bilgileri iletir (Şekil 3,4).
13.5.3. Özel işaretler ve etiketler
Aşağıdaki liste, bir işaretleyici veya etiket gerektiren durumları ve bu durum için belirli işaretleri veya etiketleri belirtir.
- Gönderici ve alıcı - gönderenin ve alıcının adı ve adresi;
- Sorumlu kişi - gönderiyle ilgili genel soruları cevaplayabilecek birinin adı ve telefon numarası;
- Kategori A Maddesi — Sınıf 6 elmas şekilli "Bulaşıcı Madde" etiketi ve uygun bir nakliye adı (teknik ad değil), UN numarası ve miktar etiketi;
- Kategori B Maddesi - "Biyolojik Madde, Kategori B" ve "UN3373" etiketleri;
- Kuru buz - Sınıf 9 "Çeşitli Tehlikeli Mallar" ve kuru buz etiketinin ağırlığı;
- Paket yönlendirme — >50 mL sıvı veya donmuş sıvı içeren ambalajların karşı taraflarındaki oklar;
- Muaf hasta örnekleri - "Muaf İnsan Örneği" veya "Muaf Hayvan Örneği" etiketi;
- Kategori A bulaşıcı madde içeren dış ambalaj - bir "UN" etiketi; bir dairenin içinde bir UN ve paketin türünü, paketin taşımak için tasarlandığı mal sınıfını, üretim tarihini, yetkilendirme kurumunu ve üreticiyi gösteren bir dizi harf ve sayı.
13.6. Belgeleme
13.6.1. Tehlikeli Mallar için Gönderici Beyanı
- Gönderici Beyanı, gönderici ile taşıyıcı arasındaki yasal bir sözleşmedir. A Kategorisi bulaşıcı maddelerin sevkiyatını belgelemek gerekir ve doğru ve okunaklı olmalıdır.
- Esasen, Beyannamenin "Tehlikeli Malların Doğası ve Miktarı" bölümünü tamamlamak için gereken IATA tarafından belirtilen tüm teknik bilgiler, IATA Tehlikeli Mallar Yönetmeliği'nin (216) mavi sayfalarında bulunabilir.
13.6.2. Acil müdahale telefon numarası
- DOT (ancak IATA değil) düzenlemeleri, Kategori A bulaşıcı maddelerin sevkiyatlarına eşlik eden Gönderici Beyannamelerinde bir acil müdahale telefon numarasının sağlanması gerektiğini belirtir.
- Numara, sevk edilen malzemenin tehlikeleri ve bir işleyicinin paketin serbest bırakılan içeriğiyle temasa geçmesi durumunda acil müdahale ve olay azaltma bilgileri hakkında bilgi sahibi olan bir kişi (telesekreter, mesaj servisi veya çağrı cihazı değil) tarafından her zaman izlenmelidir. Bu numara aynı zamanda uygun hafifletme bilgilerini sağlayabilen ticari bir hizmet olabilir. Bir ticari hizmetin telefon numarası kullanılıyorsa, hizmet sağlayıcının adının yanı sıra belgeye ticari hizmet tarafından verilen sözleşme numarası veya hizmet sözleşme numarası girilmelidir.
13.6.3. Hava Faturaları
IATA taşıyıcılarının hava kargosunu tanımlamak ve transit gönderilere eşlik etmek için hava faturaları hazırlamaları gerekmektedir. Biyolojik Maddeler Kategori B sevkiyatları gibi bazı tehlikeli mal sevkiyatları, bu belgenin hazırlanmasını gerektirir ancak bir Gönderici Beyannamesi gerektirmez. Özel hazırlık talimatları, her IATA paket talimatında ve Tehlikeli Mallar Yönetmeliğinin "Belgeleme" bölümünde ayrıntılı olarak açıklanmıştır.
13.7. Soğutucu akışkanlar
Islak buz kullanıldığında ambalaj sızdırmaz olmalıdır. Kuru buz, Sınıf 9 tehlikeli bir maldır; PI 954'e göre paketlenmelidir ve kullanımı, Kategori A maddesini göndermek için kullanılıyorsa, bir Gönderici Beyanının tamamlanmasını gerektirir.
Not: Kuru buz patlama tehlikesidir ve asla sıkıca kapatılmış bir kaba yerleştirilmemelidir. Kuru buz, ikincil kabın dışına yerleştirilmeli ve dış ambalaj CO'nun salınmasına izin vermelidir.
13.8. Eğitim ve Sertifikasyon
- Bulaşıcı maddelerin paketlenmesi ve nakliyesinde yer alan herkes bu faaliyette resmi eğitim almalıdır; her 2 yılda bir IATA tarafından ve 3 yılda bir DOT tarafından. Bir eğitim programının temel bileşenleri şunları içermelidir:
- bulaşıcı maddelerin paketlenmesi ve nakliyesi konusunda genel farkındalık ve aşinalık;
— IATA ve DOT düzenlemelerinin önemi, niteliği ve içeriği;
— paketleme ve paketleme tekniklerinin uygulamalı ve/veya gösterimleri;
— işaretleme ve etiketleme;
— tehlikeli mal sevkiyatlarının belgelenmesi;
— güvenlik eğitimi;
— eğitim öncesi ve sonrası test; ve
— eğitimin başarıyla tamamlanmasından sonra sertifikanın verilmesi. - Kabul edilebilir eğitim materyalleri ve yöntemleri, tümü profesyonel kuruluşlardan ve tehlikeli mallar için ambalaj malzemelerinin ticari tedarikçilerinden ticari olarak temin edilebilen kılavuzları, eğitim kurslarını ve atölyeleri içerir. Didaktik, uygulamalı eğitim ve gösterileri içeren bir eğitim programı veya atölye, herhangi bir hastane, laboratuvar, okul, kurum veya başka bir tesis tarafından geliştirilebilir.
- IATA ve DOT, eğitimin tüm yönlerinin belgelenmesini gerektirir. Uygun ve zamanında eğitimi kanıtlamak için kullanılan en önemli belge, eğitim tamamlandıktan sonra verilen bir sertifikadır.
— İşverenler, eğitimli her çalışan için bir kayıt tutmalıdır.
— Kayıt, çalışanın adını, eğitim yerini ve tarihini, eğitmenin adını, kurs içeriğini, test belgelerini ve eğitim sertifikasının bir kopyasını içermelidir. IATA ve DOT sertifikası sırasıyla 2 ve 3 yıl geçerlidir. - DOT, Boru Hattı ve Tehlikeli Madde Güvenliği İdaresi (PHMSA) aracılığıyla ve Federal Havacılık İdaresi, çalışanları bulaşıcı maddeleri paketleyen ve gönderen klinik laboratuvarların habersiz denetimlerini yapma, bu tesisleri eğitim düzenlemelerine uygunluk açısından denetleme ve bu tesislerdeki eğitim kayıtlarını inceleme yetkisine sahiptir. Öngörülen düzenlemelere uymayan tesisler önemli para cezalarına tabidir.
14. Acil Durum Prosedürleri ve Sorumlulukları
İşyerinde bir mikroorganizmaya ("maruz kalma") fiziksel olarak temas ettikten sonra laboratuvarla ilişkili bir enfeksiyon (LAI) kapma riski gerçektir, her zaman mevcuttur ve bir teşhis laboratuvarında ve özellikle klinik mikrobiyoloji laboratuvarında çalışmanın ayrılmaz bir parçasıdır. Bir laboratuvarcı mikroorganizmaları manipüle ettiğinde ve taşıdığında, hasta örneklerini işlediğinde ve depoladığında ve süreçte kullanılan aletleri çalıştırdığında maruz kalma potansiyeli vardır. Standart ve uygun güvenli çalışma uygulamaları ve prosedürlerine kolayca erişilebilir, çalışanlar tarafından anlaşılabilir, uygulanabilir ve takip edilebilirse, teşhis laboratuvarları çalışmak için güvenli yerler olabilir. Bu prosedürler bir maruz kalma kontrol planında ve laboratuvar kılavuzlarında uygun şekilde özetlenmelidir. Bu planlar, maruz kalmayı önlemekle ilgili temel unsurlardan oluşur ve aynı derecede önemli olan, maruz kalmadan önce ve sonra işveren ve çalışanın katılımını ve sorumluluklarını tanımlar. Bir maruziyetten sonra alınan uygun eylemler, bir maruz kalmanın bir LAI ile sonuçlanma olasılığını büyük ölçüde azaltabilir veya hatta ortadan kaldırabilir. Direktörün ve üst yönetimin tam desteğiyle iyi tasarlanmış planlar, çalışanların mikroorganizmalara maruz kalma şansını azaltabilir ve teşhis laboratuvarlarında bir güvenlik kültürü sağlamaya yardımcı olabilir.
14.1. Maruz Kalmadan Önce İşverenlerin Sorumlulukları
14.1.1. Maruz kalma kontrol planı
- İşverenlerin, maruz kalma potansiyelini en aza indirmek için iş uygulamalarını ve prosedürlerini özetleyen resmi bir plan oluşturmaları gerekir.
- İşverenler, bir çalışan maruz kaldıktan sonra alınacak eylemleri ele almak için resmi bir plana sahip olmalıdır. Plan, en azından burada sunulan unsurları (veya eşdeğerini) birleştirmek ve çalışanlar için kolayca erişilebilir olmaktır.
- Hem işveren hem de çalışan planı benimsemeli ve kendilerini, meslektaşlarını, personeli ve hastaları korumaya titizlikle katılmalıdır.
- Uygun bağışıklama, maruz kalma sonrası profilaksi ve enfeksiyon kontrol önlemlerinin dahil edilmesini sağlamak için laboratuvar direktörü, laboratuvar çalışanları ve çalışan sağlığı ve enfeksiyon kontrolü temsilcilerinden veya yerel bir site tıbbi hizmetler sağlayıcısından gelen girdilerle ilk maruziyetten önce planı geliştirin.
- Daha güvenli tıbbi cihazların ve araştırma teknolojisindeki potansiyel maruz kalma risklerini azaltabilecek veya ortadan kaldırabilecek diğer gelişmelerin yıllık incelemesini belgeleyin.
- Üst yönetim ve ön saf çalışanlar da dahil olmak üzere tüm çalışan seviyelerinden uygun katılımla bir "güvenlik kültürü" geliştirin. Potansiyel mesleki maruziyetler için cezasız bir raporlama yapısı geliştirin ve sağlık durumunda kendi bildirdiği değişiklikler olan çalışanların, gerekirse, iş performanslarını veya performans incelemelerini olumsuz etkilemeden yeniden atanmaları için hükümlere sahip olun.
— Çalışanın bir maruziyet olduğunu düşünüp düşünmediğine bakılmaksızın tüm olası olayların bildirildiğinden emin olun. Olay, maruz kalma sonrası profilaksi gerekip gerekmediğini belirlemek için işveren ve iş hekimi tarafından değerlendirilecektir.
— Bu tıbbi değerlendirmeleri gerçekleştirmek için belirlenen tıbbi uygulamalar mevcut ABD ile birlikte sağlanmalıdır. Tıbbi değerlendirmeler için Halk Sağlığı Hizmeti önerileri ve kullanılan bulaşıcı ajanlar için maruz kalma sonrası profilaksi.
— Çeşitli bulaşıcı ajanlara mesleki maruziyeti olan klinik laboratuvar çalışanlarını değerlendirmek için donanımlı olduklarından emin olmak için mesleki tıbbi sağlayıcılarla işbirliği içinde çalışın.
14.1.2. Potansiyel maruziyetlerin belgelenmesi
- Aşağıdaki bilgileri içerecek bir kayıt veya form geliştirin:
— Maruz kalmanın tarihi, saati ve yeri;
— Çalışanın adı ve çalışan numarası;
— Olayla ilgili diğer çalışanların isimleri (örn. tanıklar);
- Olay veya maruz kalmanın ayrıntıları; maruz kalma sırasında kullanılan tıbbi cihaz ve kişisel koruyucu ekipman (KKD) lot numaraları dahil olmak üzere ilgili herhangi bir cihaz veya cihazın marka adları ve üreticisi;
— Maruz kalma sırasında maruz kalan çalışanın ilgili sağlık bilgileri/durumu;
— İlk yardım da dahil olmak üzere alınan acil veya düzeltici önlemler;
— Maruz kalan çalışanın hemen veya aynı gün alması önerilen eylemler (örneğin, çalışan sağlığına veya acil servise ziyaretler, kemoprofilaksi uygulaması, doktorlarla istişareler);
— Çalışan sağlık klinisyenleri ile yapılan tartışmaların sonuçları;
— İzleme ve takip planları;
— İzleme ve takip planlarının sonuçlarını kaydetmek için alan;
— Uygun imzalar (minimum: çalışanın ve çalışanın birinci dereceden amirinin imzaları).
14.1.3. Acil müdahale ekipmanı ve tesisleri
- Çalışanlar, tüm acil durum ekipmanlarının doğru kullanımı konusunda eğitim almalıdır.
- İlk yardım çantaları laboratuvar içinde görünür ve kolay erişilebilir olmalıdır. Amerikan Ulusal Standartlar Enstitüsü (ANSI) spesifikasyonlarını karşılayan göz yıkama istasyonları ve güvenlik duşları kolayca erişilebilir olmalı ve ANSI standartlarına ve yerleştirilmelerini zorunlu kılan herhangi bir Mesleki Güvenlik ve Sağlık İdaresi (OSHA) standardına uygun olmalıdır. Ciltteki aşınmaları temizlemek, gözleri kızartmak veya cilt temasından sonra duş almak, maruz kalmanın bir LAI ile sonuçlanma olasılığını büyük ölçüde azaltabilir veya hatta ortadan kaldırabilir.
- Çalışanlara acil durum ekipman ve tesislerinin önemi ve konumları hakkında bilinçlendirilmeli ve sık sık hatırlatılmalıdır. Tüm ekipmanın düzgün çalıştığını (örneğin, göz yıkama ve duşlar için ANSI standartları) ve kabul edilebilir son kullanma tarihleri içinde (örneğin, ilk yardım çantası) belgelemek için prosedürlerin yürürlükte olduğundan emin olun.
14.1.4. Bağışıklamalar
Bağışıklama Uygulamaları Danışma Komitesi, sağlık personelinin tüm yetişkinler için önerilen aşılarla (grip, kızamık/kabakulak/kızamıkçık, suçiçeği ve tetanos/difteri/boğmaca/boğmaca) ile bağışıklamasını tavsiye etmenin yanı sıra, mesleki maruz kalma riski taşıyanlar için meningokok veya hepatit B aşısını önermektedir (211,217,218).
- Neisseria meningitidis izolatlarına rutin olarak maruz kalan mikrobiyologlar aşılanmalıdır (217). N. meningitidis izolatlarını manipüle eden laboratuvarlar, meningokok hastalığı için yüksek risk altındaki gruplar arasındadır ve laboratuvarda edinilen ölümcül meningokok hastalığı belgelenmiştir (218).
- Genel olarak çalışanların ve özel olarak bu özel durumların bağışıklanması, kurumsal çalışan sağlığı veya enfeksiyon kontrol politikalarında en etkili şekilde ele alınmaktadır. Bilgi ve güncellenmiş bağışıklama önerileri için CDC'nin Aşılar web sitesine bakın (http://www.cdc.gov/vaccines). İşverenler, laboratuvarcıları tüm aşıların varlığı ve mevcudiyeti konusunda bilgilendirecek.
14.1.5. Çalışanların eğitimi
- Çalışanlar en az yılda bir kez başlangıç eğitimi ve tazeleme eğitimi almalıdır ve bu eğitim belgelenmelidir. Eğitim, maruz kalma riskini azaltmak için tesiste kullanılan tüm gerekli laboratuvar prosedürlerini kapsayacaktır. Eğitim aşağıdaki bilgileri içerir:
— Yerinde mühendislik kontrolleri (güvenlik ekipmanı dahil);
— Numunelerin manipülasyonunda kullanılan uygun prosedürler;
— Maruz kalma durumunda izlenecek KKD ve prosedürler. - Çalışanlara haberdar edilmeli ve sık sık hatırlatılmalıdır ki
— Bir maruziyetten sonra alınan birçok makul ve yararlı eylem, maruz kalmanın bir LAI ile sonuçlanma olasılığını büyük ölçüde azaltabilir veya hatta ortadan kaldırabilir.
— Bu eylemler bir maruz kalma yönetim planında ayrıntılı olarak açıklanmıþtır.
— Çalışan sağlık klinisyenleri ve enfeksiyon kontrol pratisyenleri, maruz kaldıktan sonra konsültasyon için hazırdır.
— Klinik mikrobiyoloji laboratuvarlarında çalışanlar için uygun bağışıklamalar mevcuttur. - Ayrıca enfeksiyon semptomlarından ve takip prosedürlerinden haberdar edilmelidirler.
- Çalışanın, laboratuvarın resmi maruziyet yönetim planını desteklemek için benimsenen tüm prosedürleri okuduğunu ve anladığını belgeleyin.
14.2. Maruz Kalmadan Önce Çalışanların Sorumlulukları
Aşağıdakileri yapmak laboratuvar çalışanlarının sorumluluğundadır:
- Standart Önlemleri ve diğer yerleşik kurumsal laboratuvar güvenliği uygulamalarını her zaman takip edin.
- Bir LAI riskini artıracaksa, asla laboratuvar prosedürleri uygulayın, mikroorganizmaları manipüle edin, hasta örneklerini işleyin veya mikrobiyoloji tanımlama cihazlarını çalıştırın.
- Bir maruziyet veya şüphelenilen maruziyet meydana gelirse hemen ne yapacağını bilin.
— Laboratuvar enfeksiyon kontrol kılavuzları ve prosedürleri ve nerede bulundukları hakkında bilgi sahibi olun.
— İlk yardım çantalarının, göz yıkama istasyonlarının ve duşların yerini ve nasıl kullanılacağını bilin. - Belirli bir işi yaparken artan LAI riski olasılığını belirlemek için süpervizörü sağlık durumları (örneğin, immünokompetensi, kesikler, sıyrıklar, hamilelik, solunum sorunları) hakkında bilgilendirin.
Not: Çalışanlara sağlık durumundaki değişiklikleri bildirmeleri tavsiye edilir, ancak bunu yapmak zorunda kalamazlar. Bu durumun nasıl ele alınacağına dair bir hüküm geliştirilmeli ve yürürlükte olmalıdır. - Laboratuvarda rutin olarak izole edilen ve manipüle edilen herhangi bir aerosol bulaşan enfeksiyöz ajanın benzersiz belirtilerini ve semptomlarını bilin. Bu tür belirtileri deneyimliyse denetçilere bildirin.
14.3. Maruziyet Sonrası İşverenlerin Sorumlulukları
14.3.1. Maruz kalmanın kapsamının belirlenmesi
- Bir maruziyetin bir LAI ile sonuçlanma olasılığı, aşağıdakiler de dahil olmak üzere çeşitli değişkenlerle doğrudan ilişkilidir:
- çalışanın maruz kaldığı mikroorganizmanın konsantrasyonu;
— mikroorganizmanın fiziksel formu (örn. et suyu, koloni, liyofilize, aerosol);
- mikroorganizmanın doğıştan virülansı;
- işçinin mikroorganizmaya maruz kaldığı süre;
— KKD'nin doğru kullanımı;
- maruz kalan işçinin immüno-yeterlilik durumu; ve
— giriş portalı (sağlam, iltihaplı, aşınmış veya kesilmiş cilt; iğne çubuğu; mukoza zarı; solunum yolu; oral yol). - Herhangi bir maruziyetten hemen sonra:
— Maruz kalma olayının tüm ayrıntılarını (mümkünse maruz kalan çalışanla birlikte) inceleyin.
— Bu değişkenlerin (ve varsa diğerlerinin) maruz kalmaya dahil olma derecesini belirleyin.
— Maruz kalma derecesi ile ilgili bir karar verin.
— Çalışanın bir LAI geliştirme şansını önlemek veya azaltmak için kabul edilebilir bir eylem planını kabul edin. - Maruz kalmanın ciddiyetine bağlı olarak, çalışanın sağlık hizmeti sağlayıcısıyla iletişim veya istişare gerekli olabilir.
Not: Laboratuvarlardaki maruziyetlerin çoğu, kapsamlı el yıkama ile hafifletilir ve bazıları belgelemek ve ek önlemler almak için yeterince önemli olsa da, hepsi potansiyel olarak risklidir. - Maruz kalma, kök nedenler ve belirlenen nedenleri düzeltmek için bir eylem planı ile ilgili tüm gerçekleri belirlemek için bir kök neden analizi başlatın. Eylem planının geliştirilmesi, uygulanması ve izlenmesi gerekiyor.
- Bir olaydan sonra, personelin yeniden eğitimi garanti edilebilir ve uygun güvenlik önlemlerinin listelendiğinden emin olmak için prosedür kılavuzları inceleme gerektirebilir.
14.3.2. Maruziyetlerin belgelenmesi
- Bir maruz kalma olayıyla ilgili belge, maruz kalmanın tüm ayrıntılarını ve maruz kalma ile ilgili tüm kararları oluşturur. Form, çalışan ve çalışanın birinci dereceden amiri tarafından imzalanacaktır.
- Olaya tanık olabilecek veya temizliğe yardımcı olabilecek personelden bilgi toplayın.
- Çalışanların konsültasyon için tıbbi hizmetlere erişmesine izin verin.
14.3.3. Çalışan sağlık klinisyenleri ile istişare
Potansiyel bir maruziyet yaşayan bir çalışanın çalışanı ve amiri, çalışan sağlık doktoru veya hemşiresi ile iletişime geçerek maruz kalmayı tartışmalıdır. Bu klinisyenler, zamanında kemoprofilaksi konusunda tavsiye verme ve uygun antimikrobiyal ajanları uygulayabilme olasılığı en yüksek olan kişilerdir.
14.3.4. Maruz kalan çalışanlara danışmanlık
- Bilgi toplanmaya ve belgelenmeye devam ederken, maruz kalan çalışanı maruz kalma sonrası dönemde iyi bilgilendirin.
- Çalışana maruz kalma soruşturmasının tüm bulgularını, süpervizörün maruz kalmanın kapsamı hakkındaki görüşünü, eylemlerin ne ve ne zaman gerçekleşmesi beklendiğini, tıbbi konsültasyon için kimi görmesi gerektiğini, ek bilgilerin nerede bulunabileceğini ve hangi maruz kalma sonrası profilaksinin önerildiğini ve mevcut olduğunu söyleyin.
- Çalışana, maruz kalmadan sonra ve takip sırasında ortaya çıkan herhangi bir akut hastalık için tıbbi tavsiye ve tedavi alması konusunda tavsiyede bulunun. Çalışan, ilk ve son maruz kalma raporu formlarının bir kopyasını almalıdır.
14.3.5. Mycobacterium tuberculosis'e maruz kalma
- Bir çalışanın muhtemelen Mycobacterium tuberculosis'e maruz kaldığı durumlara yaklaşımlar, çoğu CDC kılavuzlarına dayanan kurumsal çalışan sağlığı veya enfeksiyon kontrol politikalarında en iyi şekilde ele alınır (219).
- Bir çalışan M. tuberculosis'e maruz kalırsa, örn. aerosolize M. tuberculosis'in olası solunmasıyla, işveren, bir maruziyet olup olmadığını belirlemek için çalışanın cilt veya kan testi yaptırmasını sağlamalıdır. Bir dönüşümü tespit etmek için bu testin sonuçları, bir dönüşüm tespit etmek için çalışanın temel veya önceki yıllık testi ile karşılaştırılabilir.
14.3.6. Neisseria meningitidis'e maruz kalma
- Steril bir bölgeden perkütan olarak N. meningitidis izolatına maruz kalan çalışanlar uygun bir antibiyotik ile tedavi görmelidir.
- Steril bir bölgeden bir N. meningitidis izolatına mukozal maruziyeti olan çalışanlar da antimikrobiyal kemoprofilaksi almalıdır.
14.3.7. Kan yoluyla bulaşan patojenlere maruz kalma
- İnsan immün yetmezlik virüsü ve hepatit virüsleri B ve C gibi kanla bulaşan patojenlere çalışanların perkütan veya membran maruziyetine yönelik yaklaşımlar, çoğu CDC kılavuzlarına dayanan kurumsal çalışan sağlığı veya enfeksiyon kontrol politikalarında en etkili şekilde ele alınır (220,221). Bu politikalar, hepatit B ve insan immün yetmezlik virüslerine maruz kalma için maruz kalma sonrası profilaksinin mevcudiyetini ele almaktadır.
14.4. Maruz Kaldıktan Sonra Çalışanların Sorumlulukları
- Asla bir laboratuvar yaralanması veya maruziyetin önemsiz veya önemsiz olduğunu varsaymayın.
- Çalışanlar, misilleme korkusu olmadan kendilerini, meslektaşlarını ve ailelerini korumak amacıyla tüm olayları bildirme yetkisine sahip olmalıdır. Tüm maruziyetleri derhal süpervizöre raporlayın ve varsa hangi önlemlerin alınması gerektiğini belirlemek için maruziyeti tartışın. Maruziyetin belgelenmesine aktif olarak katılın ve düzeltici eylem planının geliştirilmesinde kullanılacak ilgili bilgileri sağlayın
- Laboratuvarın onaylanmış maruz kalma sonrası süreçleriyle tam işbirliği yapın ve ihtiyatlı tıbbi tavsiyelere uyun.
- Süpervizörün talimatlarını makul olduğuna karar verildiği ölçüde takip edin.
15. Biyogüvenlik Eğitimi
Biyogüvenlik eğitimi çabaları, bir çalışan laboratuvarda çalışmaya başlamadan önce bile başlar. İşveren, çalışanın iş sorumluluklarını anlaması için doğru bir iş tanımı geliştirmelidir. İş için gerekli olan bilgi, beceri ve yetenekler tanımlanacaktır. Bu kriterleri karşılayıp karşılamadıklarını görmek için gelen çalışanları değerlendirin. Bir mentorluk planı geliştirin ve çalışanlar kendilerini maruz kalma riski altına sokacak bir pozisyona yerleştirilmeden önce eğitim boşluklarını doldurun. Bağımsız çalışmalarına izin verilmeden önce çalışanların yetkinliklerini değerlendirin ve belgeleyin.
Güvenli davranışları pekiştirmek için eğitim fırsatları devam etmeli ve tüm yönetim ve personel seviyeleri tarafından desteklenmelidir. Mesleki Güvenlik ve Sağlık İdaresi (OSHA) gereklilikleri uyarınca, bulaşıcı ajanlara maruz kalma riskleri hakkında eğitim, yeni bir çalışanın laboratuvara ilk oryantasyonu veya teknik işe atanması ile başlar ve çalışanın gerçekleştirdiği görevlere özel olmalıdır. Eğitim, bulaşıcı materyallere maruz kalmayı azaltacak veya önleyecek yöntemlerin kullanımının ve sınırlamalarının bir açıklamasını içermelidir. Bunlara mühendislik kontrolleri, iş uygulamaları ve kişisel koruyucu ekipman dahildir. Bu çalışanlar için yıllık yeniden eğitim, orijinal eğitimlerinden itibaren 1 yıl içinde sağlanmalı ve yeni mühendislik kontrolleri ve uygulamaları hakkında bilgi vurgulanmalıdır. Yıllık güvenlik eğitimi, günlük iş baskıları sırasında unutulabilecek temel biyogüvenlik önlemlerini gözden geçirme şansı sunar.
Laboratuvar personelinin güvenlik eğitimini denetleme sorumluluğu açıkça verilmelidir. Bu sorumluluk, uzmanlık kursları veya iş deneyimi yoluyla ek eğitim verilen ve eğitimi gerçekleştirme yeterliliği doğrulanan biyogüvenlik görevlisine veya diğer personele devredilebilir. Laboratuvar testleri geleneksel bir laboratuvar ortamının (örneğin, doktor ofisi, poliklinik, toplum ortamı) dışında gerçekleştirilebileceğinden, bu eğitim ve öğretim önerileri, testleri yapan çalışanlara ve bunları denetleyen kişiye uyacak şekilde uyarlanmalıdır.
15.1. Biyogüvenlik Eğitimi/Egzersizler
Çalışan eğitimi, çeşitli yöntemlerden herhangi biriyle gerçekleştirilebilir ve bunların neredeyse tamamı, belirli bir laboratuvardaki çalışanların ihtiyaçlarına uyacak şekilde uyarlanabilir veya birleştirilebilir.
- Canlı gösteriler etkilidir çünkü laboratuvar çalışanı ile soru sorabilen ve cevaplayabilen bir uzman arasında etkileşime izin verir.
- Laboratuvar bilimcilerinin normal çalışma görevlerinde karşılaşabilecekleri yaygın sorunların veya maruziyetlerin gösterileri bireyler veya gruplar için sunulabilir. Bu, kasıtlı sorunlar veya güvenlik hataları olan bir laboratuvar alanını veya iş istasyonunu arayarak (veya "önden konumlandırma") ve "Burada sorun nedir ve bunu nasıl ele alırsınız?" diye sorarak yapılabilir. "Bu sorunla karşılaşsaydın ne yapardın?" Örneğin:
— İçinde aşırı dağınıklık olan bir biyolojik güvenlik kabini (BSC) kurun veya kaputa aşırı derecede girip çıkan birini gösterin.
— Mikobakteriyoloji laboratuvarına sıvı bir kültürü, muhtemelen Mycobacterium tuberculosis'i düşürürseniz ne yapmanız gerektiğini uygulayın.
— Bir iğne takılı olarak laboratuvara bir şırınga gönderilirse ne yapılması gerektiğini tartışın.
— Santrifüjde bir numune olan kırık bir tüpü nasıl idare edersiniz?
— Yüzünüzde/gözünüzde/ağzınızda bakteriyel bir süspansiyon sıçraması varsa ne yapacağınızı gösterin.
— Sıçrayabilecekleri ve laboratuvar bilim adamının yüzüne vurabilecekleri pipet uçlarını gösterin ve doğru prosedürü gösterin.
— Pnömatik tüpte sızdıran bir numuneyle nasıl başa çıkılacağını tartışın. - Bu gösteri olaylarında vurgulananlar gibi güvenlik ihlallerinden kaçınmak veya bunlarla başa çıkmak için tüm uygun davranışlar, laboratuvar güvenlik kılavuzundaki standart bir güvenlik uygulamaları ve prosedürleri bölümünde açıklanmalıdır.
- Düzenli olarak planlanmış laboratuvar toplantıları sırasında aylık güvenlik mini sunumları sunulabilir. "Neredeyse kaçırılan" veya gerçek bir olay yaşayan çalışanlar, kurumsal gizlilik hususlarına uygun olarak deneyimlerini iş arkadaşlarıyla paylaşabilirler. Bu bilginin iş arkadaşlarından gelmesi, etkisini artıracaktır. Biyogüvenlik sorunlarını önlemek için yaratıcı çözümler ortaya çıkarın ve tartışın.
- Alternatif olarak, her laboratuvar çalışanı, bir biyogüvenlik tehlikesi olarak algıladıkları şeyi bir personel toplantısında sunum yapabilir. Bu aynı zamanda yoğun bir işyerinde kolayca unutulan günlük güvenlik sorunlarından herkesin haberdar olmasına yardımcı olacaktır.
15.2. Eğitim Güçlendirme
- İletişim ve sınavlar yoluyla eğitimin pekiştirilmesi devam eden ve rastgele olacaktır. Öngörülemeyen sınavlar veya zorluklar en etkili olabilir çünkü nasıl yanıt verileceği konusunda hızlı ve kasıtlı düşünmeyi zorlarlar. Belirli bir senaryo rastgele seçilmiş bir teknoloji uzmanına verilebilir ve bazı laboratuvarlar, gün için oturum açtıklarında bireysel çalışanlara güvenlik zorlukları gönderme teknolojik kapasitesine sahip olabilir. Alternatif olarak, eğitim takviyesi, laboratuvarda haftanın bir sorusunun yayınlanması kadar basit olabilir. Bu yaklaşımlar, tüm vardiyalar için güvenlik tatbikatlarının yapılmasını sağlayacaktır.
- Toplantı sunumları mümkün değilse, bir sayfalık kısa yazılı "güvenlik bulmacaları" mola odasında kahve eşliğinde paylaşılabilir veya dolaplara veya laboratuvar ilan panosuna asılabilir. Bir örnek "bu resmin nesi var?" biçim.
— Biyogüvenlik kabininin dışında kalıplarla çalışan bir kişinin fotoğrafını gösterin.
— Biyogüvenlik kabininde çalışan ve biyogüvenlik davlumbazının havalandırmasını tıkayan nesnelerle çalışan birini gösterin. |
— Tüp üzerinde kapak olmadan antimikrobiyal duyarlılık testi için bakteri süspansiyonlarını vordalayan bir kişiyi gösterin.
— Bir sonraki güvenlik testi ile doğru cevapları gönderin. - Personele güvenlik politikalarına uymalarını hatırlatan işaretler farkındalığı ve uyumu artırabilir. OSHA, CDC ve diğer kuruluşlar, indirilebilen ve yazdırılabilen iş yardımları sağlar. Bununla birlikte, değişmeden kalan işaretler etkinliğini hızla kaybettiğinden, bu işaretleri, personeli iş istasyonlarındaki tehlikelere karşı uyanık tutmak için tasarlanmış yeni mesajlarla döndürün.
- Amerikan Biyolojik Güvenlik Birliği web sitesine danışın (http://www.absa.org/resbslinks.html
 ) çok sayıda devlet kurumuna ve diğer meslek kuruluşuna bağlantılar, kurallar/yönetmeler/kılavuzlar, biyogüvenlik ve biyoterörizm hakkında bilgi, teknik bağlantılar ve makaleler ve bir haftalık biyogüvenlik inceleme kursları hakkında bilgiler için.
) çok sayıda devlet kurumuna ve diğer meslek kuruluşuna bağlantılar, kurallar/yönetmeler/kılavuzlar, biyogüvenlik ve biyoterörizm hakkında bilgi, teknik bağlantılar ve makaleler ve bir haftalık biyogüvenlik inceleme kursları hakkında bilgiler için.
15.3. Kritik Güvenlik Öğeleri ve Prosedürlerinin Yıllık Kontrol Listesi
Yıllık güvenlik kontrol listesi için tek bir "resmi" soru seti yok. Tüm personel tarafından birçok ortak etkinlik gerçekleştirilebilse de, listeyi gerçek iş görevlerini yansıtacak şekilde özelleştirin. Her bir iş istasyonunu, kendisiyle ilişkili biyogüvenlik risklerinin türü için analiz edin ve kontrol listesini bu risklerin her birine göre hedefleyin. Pratikse, bireysel laboratuvarlardan gerçekleştirdikleri görevler için kendi kontrol listelerini hazırlamalarını ve listelerinin amirleri ve güvenlik görevlileri tarafından gözden geçirilmelerini isteyin.
15.4. Değerlendirme ve Dokümantasyon
Çalışan eğitimi ve yetkinlik değerlendirmesi aşağıdakiler için belgelenmelidir:
- Tıbbi atıklar için kapları inşa etmek ve uygun şekilde etiketlemek;
- Tıbbi atıkların taşınması, bertarafı ve depolanması da dahil olmak üzere atık yönetimi ile ilgili tüm federal, eyalet ve yerel düzenlemeleri takiben;
- Taşıma konteynerlerinin gerekli herhangi bir Ulaştırma Bakanlığı (DOT) etiketi de dahil olmak üzere tıbbi atıkların taşınması (örneğin, "bilinen bir bulaşıcı madde" etiketi ile);
- Numunelerin taşınması;
- Tüm laboratuvar örneklerinin hastane tesisi içinde ve dışında taşınması için uygun malzemelerin - örn. kaplar, plastik torbalar, etiketleme - kullanımı;
- Laboratuvar numunelerinin taşınmasıyla ilgili tüm federal, eyalet ve yerel düzenlemelere uymak; ve
- Numunelerin tesis dışına taşınması (93).
15.5. Güvenlik Prosedürlerine Uygunluğun İzlenmesi
- Güvenlik eğitimi ve öğretiminin önemini pekiştirmek, bunu yıllık performans değerlendirmesinin bir parçası haline getirmek. Bu gözden geçirme sırasında, çalışanın yıllık eğitime katılmasını, politikaları takip etmesini ve laboratuvar genelinde güvenlik sınavlarına aktif olarak katılmasını sağlayın. Değerlendirme döneminde bir dizi olay yaşamış olanlara danışmanlık alınacak ve bu alanlarda daha yoğun bir yeniden eğitim alacaklar.
- Çalışanların, olayları Çalışan Sağlığına ve amirlerine veya yöneticilerine bildirmenin önemini anlamalarını sağlayın. Bunun çalışanın korunması için önemli olduğunu ve bir yaralanmayı veya enfeksiyonu işyerinde meydana gelmiş olabilecek bir olayla ilişkilendirmenin, çalışanı uygun şekilde tazmin etmeye ve başkalarını korumak için uygulamaları iyileştirmeye yardımcı olacağını açıklayın.
- Bir laboratuvar çalışanının çalışan sağlığı süreci boyunca "akıtıldığı" ve bu nedenle bir olayı bildirme olasılığının daha yüksek olduğu hızlandırılmış bir maruz kalma kontrol planı geliştirin.
- Amir veya yönetici, çalışanı korumak ve bu olayların izlendiğinden ve sistematik risklerin ortadan kaldırıldığından emin olmak için sorun yaşayan her çalışanı takip etmelidir.
- Mühendislik kontrollerinin yıllık bir incelemesini yapın, çünkü uygulamalardaki ve teknolojideki değişiklikler laboratuvar personelini yeni risklere sokabilir. Yeni mühendislik kontrolleri, garanti edildiği şekilde uygun kişiler tarafından gözden geçirilmelidir, örn. güvenlik görevlisi, risk yönetimi, satın alma veya görevleri sırasında iğne ve diğer kesici uçları kullanan çalışanlar.
- Laboratuvar bölümleri, pozisyonu çalışanlar arasında döndürerek bir "ayın güvenlik kaptanı" atayabilir. Güvenlik kaptanı, iyi güvenlik davranışlarını güçlendirmek ve iş arkadaşlarını güvenlik politikalarına uymaya teşvik etmektir.
- Korkunç veya tekrar eden ihlaller için cezai önlemler alın ve idari sonuçları olan olumsuz bir tutumdan ziyade güvenlik hakkında olumlu bir tutum oluşturun. Bu bağlamda, laboratuvar personeli, personel tarafından uygulanan yeni güvenlik fikirlerinin yanı sıra laboratuvarda meydana gelen güvenli olmayan uygulama veya durum örnekleri hakkında rapor vermeye teşvik edilebilecek bir güvenlik "alışverişçi" kadrosu haline gelebilir. Amaç, insanları rapor etmek değil, güvenli bir çalışma ortamını teşvik etmek ve bir sonraki personel toplantısında güvenliğin güçlendirilebilmesi ve tanınabilmesi için güvenli uygulamaların takip edilmediği durumları tanımlamaktır.
16. Sürekli Kalite İyileştirme
Biyogüvenlik için sürekli kalite iyileştirmesini tüm laboratuvar için sürekli kalite iyileştirmesi ile entegre edin. Klinik Laboratuvar Standartları Enstitüsü tarafından tanımlanan 12 kalite sistemi temeli, sürekli kalite iyileştirmesi için kapsamlı bir temel ve referans sağlar (222). Bu elementlerin her biri için daha ayrıntılı ve spesifik biyogüvenlik hususları listelenmiştir (Tablo 17).
Teşkirler
Tanya Graham, DVM, Güney Dakota Eyalet Üniversitesi, Brookings, SD'nin yardımını kabul ediyoruz; Larry Thompson, DVM, PhD, Nestle Purina Pet Care, St. Louis, MO; R. Ross Graham, DVM, PhD, Merrick and Company; Corrine Fantz, PhD, Emory University, Atlanta, GA; Thomas Burgess, PhD, and Quest Diagnostics, Tucker, GA.
Sağlık ve Güvenlik Ofisi, CDC; Amerikan Veteriner Laboratuvarı Teşhiscileri Derneği; Amerikan Biyolojik Güvenlik Derneği; Amerikan Patologlar Koleji; Amerikan Mikrobiyoloji Derneği; Halk Sağlığı Laboratuvarları Derneği; ve CDC'deki konu uzmanları tarafından sağlanan inceleme ve belgeye girdiyi takdir ediyoruz.
Referanslar
ŞEKIL 1. Biyolojik tehlikeler için risk değerlendirme süreci
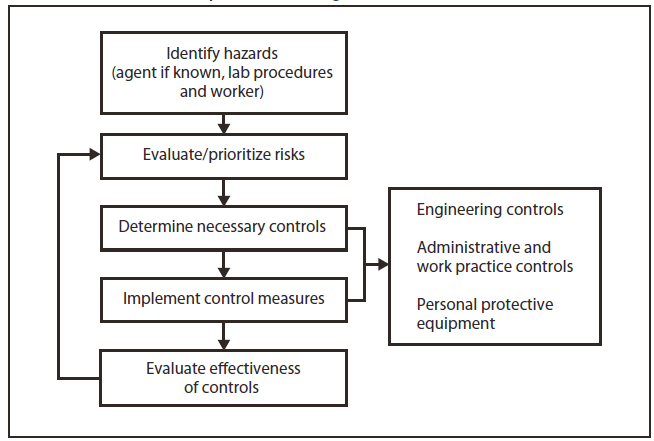
Alternatif Metin: Şekil, biyolojik bir tehlike için risk değerlendirme sürecini sunan bir akış şemasıdır.
|
TABLO 1. Enfeksiyöz ajanlara maruz kalma ile ilişkili laboratuvar aktiviteleri | |
|---|---|
|
Maruz kalma/iletim yolları |
Faaliyetler/uygulamalar |
|
Yutma/oral |
• Ağız yoluyla pipetleme • Bulaşıcı materyalin sıçraması • Kirlenmiş malzemeyi veya parmakları ağzına yerleştirmek • Yeme, içme, ruj veya dudak balsamı kullanma |
|
Perkütan aşılama/saksız cilt |
• İğneleri ve şırıngaları manipüle etmek • Kırık cam ve diğer keskin nesneleri işleme • Numune işleme için dokuyu kesmek için neşter kullanma • Atık bertarafı (uygun olmayan şekilde atılmış kesici uçlu konteynerler) |
|
Mukoza zarları ile doğrudan temas |
• Göze, ağza, buruna bulaşıcı madde sıçraması veya dökülmesi • Bulaşıcı maddeyi sağlam ve sağlam olmayan cilde sıçratma veya dökme • Kirlenmiş yüzeylerde çalışma • Kirlenmiş ekipmanın elleçlenmesi (yani, cihaz bakımı) • Örnekler veya kültür materyali içeren ilmeklerin, aşılama iğnelerinin veya sürüntülerin uygun olmayan kullanımı • Hayvanlardan ve böceklerden ısırıklar ve çizikler • Atık bertarafı • Kontakt lenslerin manipülasyonu |
|
Aerosollerin solunması |
• İğneleri, şırıngaları ve kesicileri manipüle etmek • Aşılama iğnelerini, ilmekleri ve pipetleri manipüle etmek • Örnekleri ve kültürleri manipüle etmek • Dayıntı temizleme |
|
Kaynak: Sewell DL. Laboratuvarla ilişkili enfeksiyonlar ve biyogüvenlik. Clin Micobiol Rev 1995;8:389–405 (18). |
|
|
TABLO 2. Seçilen rutin laboratuvar görevlerinin risk önceliği | ||||
|---|---|---|---|---|
|
Görev veya etkinlik |
Maruz kalma riski | |||
|
Potansiyel tehlike |
Olasılık |
Sonuç |
Risk derecelendirmesi | |
|
Alt kültür kan kültürü şişesi |
İğne çubuğu - perkütan aşılama |
Muhtemelen |
Enfeksiyon; tıbbi tedavi |
Yüksek |
|
Aerosoller — inhalasyon |
Ilımlı |
Enfeksiyon; tıbbi tedavi |
Orta |
|
|
Sıçrama - mukoza zarları ile doğrudan temas |
Ilımlı |
Enfeksiyon; tıbbi tedavi |
Yüksek |
|
|
Santrifüj |
Aerosoller — inhalasyon |
Muhtemelen |
Enfeksiyon; tıbbi tedavi |
Yüksek |
|
Gram boyaması gerçekleştirme |
Alevli slaytlardan aerosoller |
Ilımlı |
Kolonizasyon; enfeksiyon |
Ilımlı |
|
Sadece AFB smear hazırlanıyor |
Balmam veya slayt hazırlığından elde edilen aerosoller |
Muhtemelen |
Hastalık; tıbbi tedavi; hastalık |
Yüksek |
|
Katalaz testi gerçekleştirme |
Aerosoller - mukoza zarı maruziyeti |
Olası değil |
Kolonizasyon; enfeksiyon |
Düşük |
|
AFB kültürü çalışması |
Aerosoller — inhalasyon |
Muhtemelen |
Hastalık; tıbbi tedavi; hastalık |
Yüksek |
|
Kısaltma: AFB = acid-fast bacillus. |
||||
|
TABLO 3. Teşhis laboratuvarlarında çalışan laboratuvarcılar için iş güvenliği analizi örneği: tehlikeler ve kontroller | ||||
|---|---|---|---|---|
|
Görev veya etkinlik |
Tehlikeler ve önerilen kontroller | |||
|
Potansiyel tehlike |
Mühendislik kontrolleri |
İdari/iş uygulamaları |
KKD | |
|
Alt kültür kan kültürü şişesi |
İğne çubuğu—perkütan aşılama |
Daha güvenli kesiciler; geri çekilebilir iğneler; delinmeye dayanıklı kesiciler kabı |
Yeniden tazipleme yok; kesici alet kabına hemen atılır |
Eldivenler; elbise veya laboratuvar önlüğü |
|
Aerosoller—inhalasyon |
BSC veya sıçrama kalkanı |
BSC'nin içinde veya sıçrama kalkanının arkasında çalışın |
BSC'de değilse yüz koruması; eldivenler; örme manşetli önlük veya laboratuvar önlüğü |
|
|
Sıçrama—mukoza zarları ile doğrudan temas |
BSC veya sıçrama kalkanı |
BSC'nin içinde veya sıçrama kalkanının arkasında çalışın |
BSC'de değilse yüz koruması; eldivenler; önlük veya laboratuvar önlüğü |
|
|
Santrifüj |
Aerosoller—inhalasyon |
BSC; çıkarılabilir rotorlar; güvenlik kapları; kovalardaki O-ringler; plastik tüpler; sıçrama kalkanı |
BSC'de döndürün veya BSC'de rotoru yükleyin ve boşaltın; O-ringleri ve tüplerin aşınma olup olmadığını kontrol edin; cam tüp yok; açmadan önce santrifüjün durmasını bekleyin |
BSC'de değilse yüz koruması; eldivenler; örme manşetli önlük veya laboratuvar önlüğü |
|
Gram boyaması gerçekleştirme |
Alevli slaytlardan aerosoller |
Slayt ısıtıcısı |
Hava kuru veya slayt ısıtıcı kullanın |
Laboratuvar önlüğü; eldivenler (isteğe bağlı) |
|
Sadece AFB smear hazırlanıyor |
Balgamdan veya slayt hazırlığından gelen aerosoller |
BSC'de çalışmak; balgem dekontaminant; slayt ısıtıcısı |
BSC'de slayt ısıtıcısı kullanın; tüberkülosidal dezenfektan içine atın |
Laboratuvar önlüğü; eldivenler |
|
Katalaz testi |
Aerosoller— mukoza zarına maruz kalma |
BSC; tek kullanımlık tüp |
BSC'de çalışın veya tek kullanımlık tüpte çalışın |
Laboratuvar önlüğü; eldiven; göz koruması |
|
AFB kültürü çalışması |
Aerosoller—inhalasyon |
BSL-3 laboratuvar optimali; BSC minimal ile BSL-2 laboratuvarı |
BSL-3 uygulamalarını kullanarak BSC'de çalışan tüm çalışmalar* |
Manşetli kollu sağlam ön elbise; eldivenler; garanti edilirse solunum cihazı |
|
Kısaltmalar: KKD= kişisel koruyucu ekipman; BSC = biyolojik güvenlik kabini; AFB = asit-fast basil; BSL = biyogüvenlik seviyesi. * BSL-3 Uygulamaları, BSL-2 uygulamasını artı şunları içerir: kısıtlı erişim; bir BSC'de (ek KKD) gerçekleştirilen tüm işler; ve bertaraf edilmeden önce tüm atıkların dekontaminasyonu. |
||||
|
TABLO 4. Enfeksiyöz ajanlar için önerilen biyogüvenlik düzeylerinin (BSL) özeti | ||||
|---|---|---|---|---|
|
BSL |
Ajanlar |
Uygulamalar |
Birincil bariyerler ve güvenlik ekipmanı |
İkincil engeller (tesisler) |
|
1 |
Sağlıklı yetişkinlerde sürekli olarak hastalıklara neden olduğu bilinmemektedir |
Standart mikrobiyolojik uygulamalar |
Hiçbiri gerekli değil |
Laboratuvar tezgahı ve lavabo gerekli |
|
2 |
• İnsan hastalığı ile ilişkili ajanlar • Bulaşma yolları perkütan yaralanma, yutma, mukoza zarına maruz kalmayı içerir |
BSL-1 uygulaması artı: • Sınırlı erişim • Biyolojik tehlike uyarı işaretleri • "Keskin" önlemleri • Gerekli atık kontaminasyonunu veya tıbbi gözetim politikalarını tanımlayan biyogüvenlik el kitabı |
Birincil engeller: • Sınıf I veya II BSC veya bulaşıcı maddelerin sıçramasına veya aerosollerine neden olan ajanların tüm manipülasyonları için kullanılan diğer fiziksel muhafaza cihazları KKD: • Koruyucu laboratuvar giysisi; eldiven; gerektiğinde solunum koruması |
BSL-1 artı: • Otoklav mevcut |
|
3 |
• Aerosol bulaşma potansiyeli olan yerli veya egzotik ajanlar • Hastalığın ciddi veya ölümcül sonuçları olabilir |
BSL-2 uygulaması artı: • Kontrollü erişim • Tüm atıkların dektanaminasyonu • Çamaşır yıklamadan önce laboratuvar giysilerinin dekontaminasyonu • Personelden başlangıç serumu alınması |
Birincil engeller: • Ajanların tüm açık manipülasyonları için kullanılan Sınıf I veya II BSC veya diğer fiziksel muhafaza cihazları KKD: • Koruyucu laboratuvar giysisi; eldiven; gerektiğinde solunum koruması |
BSL-2 artı: • Erişim koridorlarından fiziksel ayrılık • Self-closing, çift kapılı erişim • Egzoz havası devridaim edilmemiştir • Laboratuvara negatif hava akışı |
|
Kısaltma: BSC = biyolojik güvenlik kabini; KKD = kişisel koruyucu ekipman. |
||||
|
TABLO 5. Biyolojik güvenlik kabini özelliklerinin karşılaştırılması | ||||
|---|---|---|---|---|
|
BSC Sınıfı |
Yüz hızı |
Havalandırma |
Uygulamalar | |
|
Uçucu olmayan toksik kimyasallar ve radyonüklidler |
Uçucu toksik kimyasallar ve radyonüklidler | |||
|
Ben |
75 |
HEPA filtre aracılığıyla odanın dışında veya içine |
Evet |
Dışarıda tükendiğinde*† |
|
II–A1 |
75 |
%30 HEPA filtreden odaya veya bir kanopi ünitesi aracılığıyla dışarıya havalandırıldı |
Evet (dakika miktarları) |
Hayır |
|
II–A2 |
100 |
II-A1'e benzer, ancak 100 lfpm emme hava hızına sahiptir |
Evet |
Dışarıda tükendiğinde (dakika miktarlar)*† |
|
II–B1 |
100 |
Egzoz kabini havası bir HEPA filtreden sonra özel bir kanaldan dışarıya geçmelidir. |
Evet |
Evet (dakika miktarları)*† |
|
II–B2 |
100 |
Devridaim yok; bir HEPA filtresi aracılığıyla dışarıya toplam egzoz |
Evet |
Evet (küçük miktarlar)*† |
|
III |
N/A |
Egzoz havası seri olarak iki HEPA filtreden geçer ve sert bir bağlantı yoluyla dışarıya boşaltılır. |
Evet |
Evet (küçük miktarlar)*† |
|
Kısaltmalar: BSC = biyolojik güvenlik kabini; HEPA = yüksek verimli partikül havası; lfpm = dakikada doğrusal ayak Kaynak: CDC/Ulusal Sağlık Enstitüleri. Mikrobiyolojik ve biyomedikal laboratuvarlarda biyogüvenlik. 5. bask. (1). * Kurulum, dışarıya özel bir kanal, bir in-line kömür filtresi ve bir spark-proof (explosion-proof) motor ve kabindeki diğer elektrikli bileşenler gerektirebilir. Uçucu kimyasallar kullanılıyorsa, Sınıf I veya Sınıf II, A2 Tipi kabinin bir odaya boşaltılması gerçekleşmemelidir. † Hiçbir durumda kimyasal konsantrasyon, bileşiklerin daha düşük patlama sınırlarına yaklaşmamalıdır. |
||||
|
TABLO 6. Saat başına hava değişimi (ACH) ve havadaki kirleticilerin %99 ve %99,9'unun uzaklaştırılması için gereken süre* | ||
|---|---|---|
|
ACH |
Çıkarma verimliliği için gerekli dakikalar† | |
|
%99 |
%99,9 | |
|
2 |
138 |
207 |
|
4 |
69 |
104 |
|
6 |
46 |
69 |
|
12 |
23 |
35 |
|
15 |
18 |
28 |
|
20 |
7 |
14 |
|
50 |
3 |
6 |
|
400 |
<1 |
1 |
|
Kaynak: Mycobacterium tuberculosis'in bulaşmasını önlemek için kılavuzlar. MMWR 2005 (46). * Bu tablo, kaynak hasta bölgeyi terk ettikten sonra veya aerosol üreten prosedürler tamamlandığında havadaki Mycobacterium tuberculosis'in havasını temizlemek için gereken süreyi tahmin etmek için kullanılabilir. † Havadaki konsantrasyonu %99 veya %99,9 oranında azaltmak için dakikalar içinde süre. |
||
|
TABLO 7. Bir sağlık ortamında olası parazit bulaşması (tanı laboratuvarı) | ||
|---|---|---|
|
Organizma* |
İletim şekli |
Yorumlar |
|
Protozoa (bağırsak) |
||
|
Entamoeba histolytica† (C) |
Dışkı materyali ile kontamine edilmiş gıda veya suda enfektif kistlerin, trofozoitlerin, ookistlerin veya sporların kazara yutulması; ayrıca dışkı materyalinin fomitler yoluyla doğrudan transferi (fekal-oral bulaşma) |
Taze dışkı örnekleri işlendiğinde ve incelendiğinde bulaşma daha olası hale gelir. Dışkı koruyucularına dışkı örneklerinin sunulması (ticari olarak mevcut flakonlar) riskleri azaltacaktır. |
|
Entamoeba dispar(C) |
||
|
Entamoeba coli(C) |
||
|
Entamoeba hartmanni (C) |
||
|
Endolimax nana(C) |
||
|
Iodamoeba bütschlii (C) |
||
|
Blastocystis hominis† (C) |
||
|
Giardia lamblia† (C) |
Eldivenler, kapaklı santrifüj tüpleri kullanmak ve biyolojik güvenlik kabininde çalışmak, Cryptosporidium enfeksiyonlarına yakalanma riskini azaltacaktır.Tavsiye edilmez: Toplama sıvısı olarak potasyum dikromat kullanımı (fekal koruyucu değil) ve taze dışkıda şeker flotasyonunun kullanılması. |
|
|
Dientamoeba fragilis† (T) |
||
|
Cryptosporidiumspp.† (O) |
||
|
Cyclospora cayetanensis† (O) |
||
|
İzospora belli†(O) |
||
|
Mikrosporidia† (S) |
||
|
Protozoa (diğer vücut bölgeleri) |
||
|
Serbest yaşayan amebae (Acanthamoeba, Naegleria, Balamuthia, Sappinia) |
Organizma içeren sıvıların kazara solunması; organizmaların kontamine eller yoluyla gözlere kazara bulaşması |
Kültürler ve hasta örnekleri ile çalışırken eldivenler ve biyolojik güvenlik kabini içinde sıvı maddelerin transferi önerilir. |
|
Trichomonas vaginalis |
Kirlenmiş aerosoller veya eller yoluyla organizmaların yanlışlıkla gözlere bulaşması (örn.) |
Free-living amebae ile aynı |
|
Helmintler (bağırsak) |
||
|
Enterobius vermicularis (E) |
Enfektif yumurtaların solunması/yutulması |
Çocuklarda çok yaygın, asemptomatik |
|
Strongyloides stercoralis (IL) |
Enfektif larvaların dışkı materyalinden deri penetrasyonu |
Larva iyileşmesi için taze dışkı kültürleri/konsantreleri ile çalışırken maruz kalma olası/olası |
|
Hymenolepis nana (E) |
Enfektif yumurtaların yutulması (fekal-oral) |
Taze dışkıda enfektif yumurtaların yutulması, insanlarda yetişkin solucana yol açabilir. |
|
Taenia solium (E) |
Enfektif yumurtaların solunması/yutulması sistiserkoza yol açabilir. |
Korunmamış gravid proglottids (solucan türleşmesi için mürekkep enjeksiyonu) ile çalışırken maruz kalma çok muhtemeldir. |
|
Kan/doku protozoa |
||
|
Leishmania spp. |
Hasta lezyonundan bulaşıcı materyalin doğrudan teması veya aşılanması; kültür veya hayvan aşılama çalışmalarından materyalin kazara aşılanması. |
Hamsterden gelen kültür formları/organizmaları bulaşıcı olacaktır. |
|
Trypanosoma spp. |
Leishmania spp. için olduğu gibi |
Kültürler, özel konsantrasyon teknikleri olası maruz kalma araçlarını temsil eder. |
|
Plasmodium spp. |
Kazara aşılama beş türden herhangi birini iletebilir (P. vivax, P. ovale, P. falciparum, P. malariae, P. knowlesi) |
Kan her zaman dikkatli kullanılmalıdır; açık kesiklerden kaçının. |
|
Toxoplasma gondii |
Kedi dışkısında oositlerin solunması/yutulması (veteriner durumu); doku kültüründen kazara taşikoitlerin aşılaması, kan tüpü, hayvan izolasyonu (fare periton boşluğu) |
Birçok insanda zaten geçmişte maruz kalmayı gösteren Toxoplasma'ya karşı antikorlar olmasına rağmen, hastalığın büyük enfeksiyon dozundan kaynaklandığı laboratuvar olayları belgelenmiştir. |
|
Ektoparazitler |
||
|
Pediculus spp. |
Saçla gönderilen numuneler laboratuvarda kolayca bulaşabilir. |
Dikkatli bir şekilde ele alınması, eklembacaklıların sabitlenmesi, bulaşma ile ilgili olası sorunları önleyecektir. |
|
Sarcoptes scabiei |
Cilt kazıma veya başka yollarla bulaşma mümkün olabilir, ancak olası değildir. |
Dikkatli kullanım, potasyum hidroksit (KOH) ile numunelerin hazırlanması herhangi bir sorunu önleme eğilimindedir. |
|
Dipterous sinek larvaları (Myiasis) |
Bulaşma herhangi bir yerde gerçekleşebilir. |
Sineklerden korunmak potansiyel sorunu çözecektir. |
|
Kısaltmalar: C = kist; T = trofozoit; O = ookist; IL = enfektif larvalar; E = yumurta; S = spor * Her olası parazit tabloya dahil değildir; bahsedilenler en olası bulaşma olasılıklarını temsil eder. † Potansiyel olarak patojenik bağırsak protozoası. |
||
|
KUTU 1. Laboratuvarda edinilen paraziter enfeksiyonlara potansiyel maruziyetler |
|
Parenteral veya aerosolizasyon • Bir iğneyi yeniden kaplama • İğneyi şırıngadan çıkarma • Tezgahın üzerinde bir iğne bırakarak yukarı doğrultun • Bir şırınga düşürmek • Ucunu kile bastırırken hematokrit tüpünün kırılması • Ajite hastada damar delinmesi yapılması • Aşılama prosedürü sırasında ani hayvan hareketi • Tenya proglottid enjeksiyonu sırasında aerosollerin oluşturulması • Kültürlerle (bakteri, virüs, mantar, kan parazitleri, free-living amebae) çalışırken aerosollerin oluşturulması Hayvan veya vektör ısırıkları • Enfekte bir hayvan tarafından ısırıldı (örneğin, fare veya hamster) • Enfekte sivrisinek veya kene tarafından ısırıldı (örn. sivrisinek kolonisi) Cilde maruz kalma • İşlem sırasında eldiven giymemek • Laboratuvar önlüğü giyilmemesi (kapalı kollu, önü kapalı giysiler) • Enfeksiyöz materyallerin taşınması sırasında yanlışlıkla yüze veya gözlere dokunma • Göz, burun veya ağzın potansiyel aerosollere maruz kalması Yutma • Ağız pipetleme • Öksüren veya yetersiz kalan hayvandan kaynaklanan inokülum damlacıkları püskürtülür Potansiyel maruziyetlerin diğer nedenleri • Düzensiz laboratuvar tezgahı ortamında çalışmak • Çok hızlı çalışmak • Uygun eğitim alamama • Ajanın insanlar için bulaşıcı olmadığı varsayımı • Aracı(lar)ın artık uygulanabilir olmadığı varsayımı • Kusurlu ekipman kullanımı |
|
TABLO 8. Parazitlerin ve diğer organizmaların antiseptiklere ve dezenfektanlara karşı direnci (en çoktan en az dirençliye) | |
|---|---|
|
Organizma türü |
Örnekler |
|
Prionlar |
Creutzfeldt-Jakob hastalığı, Sığır süngerimsi ensefalopati |
|
Coccidia |
Cryptosporidium spp. |
|
Mikrosporidyal sporlar |
Enterositozoon, Ensefalitozoon, Pleistophora, Trachipleistophora |
|
Bakteriyel sporlar |
Bacillus, Clostridium difficile |
|
Mikobakteriler |
Mycobacterium tuberculosis, M. avium |
|
Kistler |
Giardia lamblia |
|
Küçük zarfsız virüsler |
Çocuk felci virüsü |
|
Trofozoitler |
Acanthamoeba |
|
Gram-negatif bakteriler (sporülasyon yapmayan) |
Pseudomonas |
|
Mantarlar |
Candida, Aspergillus |
|
Büyük zarfsız virüsler |
Enterovirüsler, Adenovirüs |
|
Gram-pozitif bakteri |
Staphylococcus aureus, Enterococcus |
|
Lipid kaplı virüsler |
İnsan immün yetmezlik virüsü, Hepatit B virüsü |
|
TABLO 9. Hücre kültürleri ve hücre kültürü reaktifleri oluşturmak için kullanılabilecek hücre kültürleri, organlar ve dokularla ilişkili seçilmiş maceracı ajanlar | ||
|---|---|---|
|
Enfektiyöz ajan |
Kaynak |
Referanslar |
|
Adenovirüs |
İnsan böbreği, pankreas, bazı adenovirüs hücre hatlarını değiştirdi, rhesus maymun böbrek hücreleri |
(130–134) |
|
Sıvır virüsleri Sığır rinotrasheitis virüsü Sığır ishali virüsü Parainfluenza tip 3 Sığır enterovirüsü Sıvır herpes virüsü Sıvır sinsityal virüsü |
Sığır serumu, fetal sığır serumu (sığır serumunun ultrafiltrasyonu nedeniyle bugün önemli ölçüde daha düşük risk) |
(135) |
|
Sitomegalovirüs |
Böbrek, insan sünnet derisi, maymun böbrek hücreleri |
(133,134,136) |
|
Epstein-Barr virüsü (EBV) |
Bazı lenfoid hücre hatları ve EBV-dönüşmüş hücre hatları, insan böbreği |
(137) |
|
Hepatit B virüsü |
İnsan kanı, karaciğer |
(138) |
|
Herpes simpleks virüsü |
İnsan böbreği |
(139,140) |
|
Herpes virüs grubu |
Maymun böbrek hücreleri |
(133,134) |
|
İnsan veya simian immün yetmezlik virüsü |
Enfekte insanlardan veya maymunlardan kan hücreleri, serum, plazma, katı organlar |
(141–143) |
|
HTLV-1 |
İnsan böbreği, karaciğer |
(144–147) |
|
Lenfositik koryomenenjit virüsü |
Çoklu hücre hatları, fare dokusu |
(148–150) |
|
Mikoplazmalar |
Birçok hücre kültürü |
(151) |
|
Myxovirüs (SV5) |
Maymun böbrek hücreleri |
(133,152) |
|
Domuz parvovirüsü |
Fetal domuz böbrek hücreleri, tripsin preparatları |
(153) |
|
Kuduz virüsü |
İnsan kornea, böbrek, karaciğer, iliak damar kanalı |
(154–163) |
|
Simian adenovirüsleri |
Rhesus, cynomologous ve Afrika yeşil maymun böbrek hücreleri |
(133,164) |
|
Simian köpüklü virüs |
Rhesus, cynomologous ve Afrika yeşil maymun böbrek hücreleri |
(133,134,152,165) |
|
Simian virüsü 40 (SV40) |
Rhesus maymun böbrek hücreleri |
(135,166,167) |
|
Simian virüsleri 1–49 |
Rhesus maymun böbrek hücreleri |
(133,135,165) |
|
Domuz torku teno virüsü |
Tripsin, domuz kökenli biyolojik bileşenler |
(168) |
|
Sincap maymunu retrovirüsü |
Çoklu hücre hatları, ticari interferon preparatları |
(169,170) |
|
Batı Nil virüsü |
İnsan kanı, kalp, böbrek, karaciğer, akciğer, pankreas |
(171–191) |
|
TABLO 10. Süpervizör veya laboratuvar direktörü bildirimi veya müdahalesi gerektiren tetikleyici olaylar | |||
|---|---|---|---|
|
Etkinlik |
Tipik nedenler |
Yüksek riskli nedenler | |
|
Numune işleme/oturum açma tezgahı |
|||
|
Kolluk görevlisi tarafından gözetim zinciri formu ile getirilen numune |
Saldırı vakası çalışması |
Potansiyel BT/BC numunesi |
|
|
Şüpheli temsilci Test Etme/İşlem Yapma listesinde |
Sipariş girişinde büro hatası |
Yüksek riskli enfeksiyonu olan bir hastadan olabilir |
|
|
Olağandışı (biyolojik olmayan) veya onaylanmamış numune tipi veya kabı |
Sipariş girişinde büro hatası; uygunsuz sipariş |
• Tozlar, çevresel örnekler, hayvan örnekleri, giysiler, gıda örnekleri, cansız nesneler BT/BC ajanları içerebilir. • Laboratuvara bir BT/BC ajanı sokma girişimini temsil edebilir. |
|
|
Floresan antikor tezgahı |
|||
|
Kontroller ve diğer pozitif numuneler normal şekilde lekelendiğinde loş boyama |
Hücrelerde azalmış antijen ekspresyonu |
Başka bir bulaşıcı ajanla çapraz reaksiyon |
|
|
Sıradışı boyama deseni |
Kuyuya yanlış antikor eklendi; antikorlar inkübasyon sırasında birlikte çalıştı |
• Değiştirilmiş virüs veya genetik/antijenik varyant • Başka bir ajanla çapraz reaksiyon |
|
|
Olağandışı hücre tiplerinin boyanması |
Kuyuya yanlış antikor eklendi; antikorlar inkübasyon sırasında birlikte çalıştı |
Değişmiş konak aralığına sahip bulaşıcı ajan; başka bir ajanla çapraz reaksiyon |
|
|
Hücre kültürü tezgahı |
|||
|
CPE paterni ve hücre tropizmi olağandışıdır |
Olağandışı/beklenmeyen patojen; numunede BT/BC ajanı |
||
|
Tanıdık CPE modeli ancak alışılmadık bir hücre tipinde |
Genetik sürüklenme; alt türler mevcut |
Olağandışı/beklenmeyen patojen; numunede BT/BC ajanı |
|
|
Belirtilen numune kaynağından beklenmeyen CPE/HAd paterni |
Kaynak girerken Clerical hatası |
Olağandışı/beklenmeyen patojen; numunede BT/BC ajanı |
|
|
Onay protokolleri çalışmıyor |
Genetik veya antijenik sürüklenme |
Olağandışı/beklenmeyen patojen; numunede BT/BC ajanı |
|
|
Nükleik asit testi |
|||
|
Değiştirilmiş erime eğrisi şekli, çok fazla pik, kontroller ve diğer hasta eğrileri normal olduğunda değiştirilmiş T |
Ajanda genetik varyasyon; zayıf ekstraksiyon; primer dimerler |
Olağandışı/beklenmeyen patojen; birden fazla ajan mevcut; kimerik, rekombinant veya reassorant patojen |
|
|
Amplifikasyon eğrisinin eğimindeki değişiklik |
Ajanda genetik varyasyon; zayıf ekstraksiyon; numune inhibisyonu |
Olağandışı/beklenmeyen patojen; kimerik, rekombinant veya reassortant patojen |
|
|
Kısaltmalar: BT = biyoterörizm; BC = biyosuç; CPE = sitopatik etkiler; HAd = hemadsorpsiyon; Erime sıcaklığı. |
|||
|
TABLO 11. Ev tipi ağartıcı ile uyumlu olmayan bileşiklerin listesi (sodyum hipokorit) | |
|---|---|
|
Uyumsuz malzeme* |
Karıştırmadan olası sonuç |
|
Asitler ve asidik bileşikler† gibi: |
|
|
şap (alüminyum sülfat) alüminyum klorür demir veya demir klorür demir veya ferrik sülfat nitrik asit hidroklorik asit (HCl) sülfürik asit hidroflorik asit florosilisik asit fosforik asit tuğla ve beton temizleyiciler klorlu demir sülfat çözeltileri |
Klor gazının salınması şiddetli bir şekilde meydana gelebilir. |
|
Amonyak içeren kimyasallar ve temizleme bileşikleri† gibi: |
|
|
amonyum hidroksit amonyum klorür amonyum silikoflorür amonyum sülfat kuaterner amonyum tuzları (quats) üre |
• Patlayıcı bileşiklerin oluşumu. • Klor veya diğer zararlı gazların salınması. |
|
Organik kimyasallar ve kimyasal bileşikler† gibi: |
|
|
Yakıtlar ve akaryakıtlar aminler metanol organik polimerler propan etilen glikol böcek öldürücüler, çözücüler ve solvent bazlı temizleme bileşikleri |
• Klorlu organik bileşiklerin oluşumu. • Patlayıcı bileşiklerin oluşumu. • Klor gazı salınımı şiddetli olarak meydana gelebilir. |
|
Metaller§ gibi: |
|
|
Bakır Nikel vanadyum kobalt Demir molibden |
Oksijen gazı salınması, genellikle şiddetli bir şekilde oluşmaz. Kapalı bir sistemin aşırı basıncına/kopmasına neden olabilir. |
|
Hidrojen peroksit |
Oksijen gazının salınması şiddetli bir şekilde meydana gelebilir. |
|
Aşağıdakiler gibi indirgeyici ajanlar: |
|
|
sodyum sülfit sodyum bisülfit sodyum hidrosülfit sodyum tiyosülfat |
Isının evrimi, sıçramaya veya kaynamaya neden olabilir. |
|
Aşağıdakiler gibi oksitleyici ajanlar: |
|
|
sodyum klorit |
Klor dioksit, klor ve oksijen gazı salınımı. pH düşürüldüğü için artan oran. |
|
Güneş ışığı veya UV ışığı ile doğrudan temastan kaçının |
Oksijen gazı salınması, genellikle şiddetli bir şekilde oluşmaz. Kapalı bir sistemin aşırı basıncına/kopmasına neden olabilir. |
|
Kaynak: The Chlorine Institute, Inc., Arlington, VA. İzin alınarak yeniden basıldı. * Liste her şey dahil değildir. † Bu bileşiklerin bazıları pencere, drenaj, klozet ve yüzey temizleyicileri, yağ gidericiler, antifriz ve su arıtma veya yüzme havuzu kimyasalları gibi yaygın ev, otomotiv ve endüstriyel ürünlerde bulunabilir. Bilgi için ürün etiketleri, ürün üreticileri, sodyum hipoklorit tedarikçileri veya Klor Enstitüsü'ne danışın. § Paslanmaz çelik, alüminyum, karbon çeliği, krom çelik, pirinç, bronz, Inconel, Monel veya diğer yaygın metaller içeren borulama ve malzeme taşıma ekipmanlarından kaçının. |
|
|
TABLO 12. OIE risk grupları ve CDC/NIH biyogüvenlik seviyesi (BSL) sınıflandırmaları | |
|---|---|
|
Seviye |
Karakterizasyon |
|
OIE risk grubu |
|
|
1 |
Hastalığa neden olma olasılığı düşük; bulaşıcı olarak kabul edilmez |
|
2 |
Orta bireysel ve düşük topluluk riski; ciddi hastalığa neden olma veya bulaşma olasılığı; etkili tedavi ve önleme mevcut |
|
3 |
Yüksek bireysel ve toplum riski; ciddi enfeksiyonlara neden olur ancak kolayca bulaşmaz; etkili tedavi ve önleme genellikle mevcuttur |
|
4 |
Yüksek bireysel ve topluluk riski; kolayca bulaşan ve etkili bir tedavi veya önleme mevcut değil |
|
CDC/NIH BSL Sınıfı |
|
|
1 |
Sağlıklı yetişkin insanlarda sürekli olarak hastalığa neden olduğu bilinmeyen iyi karakterize edilmiş ajanlar; laboratuvar personeli ve çevre için minimum potansiyel tehlike |
|
2 |
Personel ve çevre için orta derecede potansiyel tehlike ajanları |
|
3 |
Soluma yoluna maruz kalmanın bir sonucu olarak ciddi veya potansiyel olarak ölümcül hastalıklara neden olan yerli ve egzotik ajanlar |
|
4 |
Aerosol-bulaşan laboratuvar enfeksiyonları ve yaşamı tehdit eden hastalık için yüksek bireysel risk oluşturan tehlikeli ve egzotik ajanlar |
|
Kısaltmalar: OIE = Dünya Hayvan Sağlığı Örgütü; NIH = Ulusal Sağlık Enstitüleri Kaynak: Veteriner mikrobiyoloji laboratuvarı ve hayvan tesislerinde Biyogüvenlik ve biyogüvenlikten uyarlanmıştır. İçinde: Karasal hayvanlar için teşhis testleri ve aşılar için OIE el kitabı, 6. Baskı. 2008 (209); ve CDC/Ulusal Sağlık Enstitüleri. Mikrobiyolojik ve biyomedikal laboratuvarlarda biyogüvenlik. 5. bask. 2007 (1). |
|
|
TABLO 13. CDC/NIH BSL uygulamaları ve ekipmanları | ||
|---|---|---|
|
BSL |
Uygulamalar |
Güvenlik ekipmanı ve tesisleri |
|
1 |
Standart mikrobiyolojik uygulamalar |
Hiçbiri gerekli değil |
|
2 |
• BSL-1 uygulamaları • Sınırlı erişim • Biyolojik tehlike işaretlerini sergileyin • Keskin önlemler • Patojenlerle eğitilmiş personel • Güvenlik kılavuzu mevcuttur |
• Numune işleme ve aerosol veya sıçrama üreten işler için kullanılan BSC • Gerektiğinde KKD (ceketler, eldivenler, yüz siperleri) • Otoklav mevcut |
|
3 |
• BSL-2 uygulamaları • Kontrollü erişim • Personelden temel serum toplayın |
• BSL-2 ekipmanı/tesisleri • BSC, tüm örnekler ve kültürlerle çalışmak için kullanılır • Gerektiğinde KKD (gelinlik ve maskeler) • Negatif basınçlı hava akışı • Kendi kendine kapanan çift kapılar • Egzoz havası devridaim edilmemiştir |
|
4 |
• BSL-3 uygulamaları • Girmeden önce kıyafeti değiştirin • Çıkışta duş • Çıkışta tüm atıkları dekontamine edin |
• BSL-3 ekipmanı/tesisleri • Ayrı bina veya tesis • Tüm prosedürler için BSC ve tam gövdeli, hava ile sağlanan pozitif basınç giysisi • Özel havalandırma ve dekontaminasyon sistemi |
|
Kısaltmalar: NIH = Ulusal Sağlık Enstitüleri; BSL = biyogüvenlik seviyesi; BSC = biyolojik güvenlik kabini; KKD = kişisel koruyucu ekipman. Kaynak: CDC/Ulusal Sağlık Enstitüleri'nden uyarlanmıştır. Mikrobiyolojik ve biyomedikal laboratuvarlarda biyogüvenlik. 5. bask. 2007 (1). |
||
|
KUTU 2. Veteriner tanı laboratuvarında bulunabilecek risk grupları 2 ve 3*'teki yaygın zoonotik mikroorganizma örnekleri |
|
Grup 2 • Virüsler: Grip virüsleri tip A, B, C; Newcastle hastalığı virüsü; parapoxvirüs (Orf); Batı Nil virüsü • Bakteri: Alcaligenes spp., Arizona spp., Campylobacter spp., Chlamydophila psittaci (nonavian), Clostridium tetani, Clostridium botulinum,Corynebacterium spp., Erysipelothrix rhusiopathiae, Escherichia coli, Haemophilus spp., Leptospira spp., Listeria monocytogenes, Moraxella spp.,Mycobacterium avium, Pasteurella spp., Proteus spp., Pseudomonas spp., Salmonella spp., Staphyloccus spp., Yersinia enterocolitica, Yersini • Mantarlar: Aspergillus fumigatus, Microsporum spp., Trichophyton sp., Blastomyces dermatitidis (dokular), Coccidioides immitis (dokular), Cryptococcus neoformans, Histoplasma capsulatum (dokular), Sporothrix schenkii Grup 3 • Virüsler: Kuduz virüsü; at ensefalomyelit virüsü (doğu, batı, Venezuela); Japon ensefalit virüsü; yükleyen hasta virüs • Bakteriler: Bacillus anthracis, Burkholderia mallei, Brucella spp., Chlamydophila psittaci (yalnızca kuş türleri), Coxiella burnetii, Mycobacterium bovis • Mantarlar: Blastomyces dermatitidis sporları (yalnızca kültürler), Coccidioides immitis sporları (yalnızca kültürler), Histoplasma capsulatum sporları (yalnızca kültürler) Kaynak: Karasal hayvanlar için teşhis testleri ve aşılar için OIE el kitabından uyarlanmıştır, 6. baskı. 2008 (209). * Dünya Hayvan Sağlığı Örgütü tarafından tanımlandığı gibi (bkz. Tablo 12). |
|
KUTU 3. Yüksek sonuçlu hayvancılık patojenleri ve seçkin ajanlar |
|
Hayvancılık Afrika at hastalığı virüsü Afrika domuz vebası virüsü Akabane virüsü Kuş gribi virüsü (yüksek patojenik) Mavi dil virüsü (egzotik) Sığır süngerimsi ensefalopati Deve çistilegi virüsü Klasik domuz vebası virüsü şap hastalığı virüsü Keçi çileği virüsü Japon ensefalit virüsü Topaklı cilt hastalığı virüsü Menangle virüsü Mycoplasma capricolum alt türleri Mycoids küçük koloni (MmmSC) (bulaşıcı sığır plöropnömoni) Peste des petits ruminants virüsü Rinderpest virüsü Koyun çilek hastalığı virüsü Domuz veziküler hastalık virüsü Veziküler stomatit virüsü (egzotik)—Indiana alt tipleri VSV-IN2, VSV-IN3 Virülent Newcastle hastalığı virüsü ABD Tarım Bakanlığı/Sağlık ve İnsan Hizmetleri Bakanlığı örtüşme ajanları Bacillus anthracis Brucella kürtajı Brucella melitensis Brucella suis Burkholderia mallei Burkholderia pseudomallei Hendra virüsü Nipah virüsü Rift Vadisi ateş virüsü Venezuela at ensefalit virüsü Kaynak: USDA/APHIS seçici ajan ve toksin listesinden uyarlanmıştır, 2010. (http://www.aphis.usda.gov/programs/ag_selectagent/ag_bioterr_toxinlist |
|
TABLO 14. Kuduz maruz kalma öncesi profilaksi kılavuzu — Amerika Birleşik Devletleri, 2008 | |||
|---|---|---|---|
|
Risk kategorisi |
Riskin doğası |
Tipik popülasyonlar |
Maruz kalma öncesi öneriler |
|
Sürekli |
Virüs sürekli olarak, genellikle yüksek konsantrasyonlarda bulunur. Tanınmaması muhtemel spesifik maruziyetler. Isırık, ısırmama veya aerosol maruziyeti. |
Kuduz araştırma laboratuvarı işçileri; kuduz biyolojik üretim işçileri. |
İlköğretim. Her 6 ayda bir serolojik test; antikor titresi kabul edilebilir seviyenin altındaysa güçlendirici aşı. * |
|
Sık |
Maruz kalma genellikle epizodiktir, kaynak tanınır, ancak maruz kalma da tanınmayabilir. Isırık, ısırmama veya aerosol maruziyeti. |
Kuduz teşhis laboratuvarı çalışanları, mağaracılar, veteriner hekimler ve personel ve kuduzun enzootik olduğu bölgelerde hayvan kontrol ve vahşi yaşam çalışanları. Sık sık yarasaları idare eden tüm kişiler. |
İlköğretim. Her 2 yılda bir serolojik test; antikor titresi kabul edilebilir seviyenin altındaysa güçlendirici aşı. * |
|
Seyrek (genel olarak nüfustan daha büyük) |
Kaynak tanındığı için neredeyse her zaman epizodik maruz kalma. Isırık veya ısırma maruziyeti. |
Kuduzun nadir olduğu bölgelerde karasal hayvanlarla çalışan veteriner hekimler ve hayvan kontrol personeli. Veterinerlik öğrencileri. Kuduzun enzootik olduğu bölgeleri ziyaret eden gezginler ve biyolojikler de dahil olmak üzere uygun tıbbi bakıma anında erişim sınırlıdır. |
İlköğretim. Serolojik test veya güçlendirici aşı yok. |
|
Nadir (genel nüfus)* |
Maruz kalma her zaman kaynak tanındığı epizodiktir. Isırık veya ısırma maruziyeti. Kabul edilebilir minimum antikor seviyesi, hızlı floresan odak inhibisyon testi ile 1:5 serum seyreltmesinde tam virüs nötralizasyonudur. Titre bu seviyenin altına düşerse bir hatırlatıcı doz uygulanmalıdır. |
Kuduzun epizootik olduğu bölgelerdeki kişiler de dahil olmak üzere ABD nüfusu genel olarak. |
Aşı gerekli değil. |
|
Kaynak: CDC. İnsan kuduz önleme — Amerika Birleşik Devletleri, 2008. MMWR 2008 (212). * Kabul edilebilir minimum antikor seviyesi, hızlı floresan odak inhibisyon testi ile 1:5 serum seyreltmesinde tam virüs nötralizasyonudur. Titre bu seviyenin altına düşerse bir hatırlatıcı doz uygulanmalıdır. |
|||
|
TABLO 15. IATA bölümü 6.2 bulaşıcı maddelerin türleri ve sınıflandırmaları | |
|---|---|
|
Bulaşıcı madde türü |
IATA sınıflandırması |
|
Kategori A maddesi |
Kategori A |
|
Kategori B maddesi |
Kategori B* |
|
Hasta numunesi |
|
|
Kategori A kriterlerini karşılar |
Kategori A |
|
Kategori B kriterlerini karşılar |
B Kategorisi |
|
Kategori A veya B kriterlerini karşılamıyor |
Muaf insan veya hayvan örneği |
|
Muaf insan veya hayvan örneği |
Muaf insan veya hayvan örneği |
|
Genetiği değiştirilmiş mikroorganizma |
|
|
Kategori A kriterlerini karşılar |
Kategori A |
|
Kategori B kriterlerini karşılar |
B Kategorisi |
|
Kategori A veya B kriterlerini karşılamıyor |
Genetiği değiştirilmiş organizma |
|
Muaf madde |
Hiçbiri |
|
Biyolojik ürün† |
Hiçbiri |
|
Enfekte hayvan† |
Hiçbiri |
|
Tıbbi atık† |
Hiçbiri |
|
Kısaltma: IATA: Uluslararası Hava Taşımacılığı Birliği * Kategori B maddeleri için uygun sevkiyat adı Biyolojik Madde, Kategori B'dir. †Madde bu kılavuzda ayrıntılı olarak ele alınmamıştır. |
|
ŞEKIL 2. Sevkiyat için bulaşıcı maddeyi sınıflandırma algoritması
Alternatif Metin: Şekil, sevkiyat için bulaşıcı bir maddeyi sınıflandırma sürecini sunan bir akış şemasıdır.
|
TABLO 16. Muaf insan örnekleri, Kategori B maddeleri ve Kategori A maddeleri için paketleme gerekliliklerinin özeti | |||
|---|---|---|---|
|
Paketleme gereksinimi |
Numune/madde | ||
|
Muaf insan örnekleri* |
Kategori B† |
Kategori A§ | |
|
İç kaplar |
|||
|
Sızdırmaz birincil ve ikincil kaplar |
Evet |
Evet |
Evet |
|
Basınca dayanıklı birincil veya ikincil kap |
-¶ |
Evet |
Evet |
|
Birincil ve ikincil kaplar arasında emici** |
Evet |
Evet |
Evet |
|
İkincil kap ve dış ambalaj arasındaki içeriklerin listesi |
— |
Evet |
Evet |
|
Pozitif olarak mühürlenmiş birincil kap |
— |
Hayır |
Evet |
|
Dış konteyner |
|||
|
Sert dış ambalaj |
— |
Evet |
Evet |
|
Sıkı üretim spesifikasyonları |
Hiçbiri†† |
Birkaç |
Birçok |
|
Sorumlu kişinin adı ve sayısı |
— |
Evet§§ |
Evet |
|
İşaretler ve etiketler |
Evet¶¶ |
Daha az |
Daha fazla |
|
Yolcu veya kargo uçağı için miktar sınırları |
|||
|
Her birincil kap için maksimum |
— |
1 L (1 kg) |
50 mL (50 g) |
|
Dış ambalaj için toplam maksimum |
— |
4 L (4 kg) |
50 mL (50 g) |
|
Belgeleme |
|||
|
Tehlikeli Mallar için Gönderici Beyanı |
— |
Hayır |
Evet |
|
Acil müdahale telefon numarası |
— |
Hayır |
Evet |
|
Maliyetler |
|||
|
Maddeyi paketlemek için işçilik ve malzeme maliyeti |
En az |
Daha fazla |
Çoğu |
|
* Uluslararası Hava Taşımacılığı Birliği (IATA) ve ABD Ulaştırma Bakanlığı (DOT), muaf insan örneklerinin paketlenmesi ve nakliyesi için yalnızca minimum standartlar (yani, ayrıntılı ve numaralı paketleme talimatları yoktur) sağlar. † Paketleme talimatları 650. § Paketleme talimatları 620. ¶ IATA veya DOT tarafından belirtilmemiş gereksinim. ** Doku ve katı agar ortam kültürleri veya eğim gibi katı maddeler için gerekli değildir. †† IATA, bunun "amaçlanan kapasitesi, kütlesi ve kullanım amacı için yeterli güce sahip" olması gerektiğini belirtir. §§ Dış ambalaja veya hava konşimentosuna yerleştirilebilir. ¶¶ Sadece "Muaf İnsan Örneği" veya "Muaf Hayvan Örneği" gereklidir. |
|||
ŞEKIL 3. Tamamen etiketlenmiş bir dış ambalaj. Ambalajın içindeki birincil kap bir Biyolojik Madde, Kategori B bulaşıcı madde içerir ve PI 650'ye göre paketlenmiştir.
Kısaltma: PI = paketleme talimatları.
Alternatif Metin: Şekil, Kategori B bulaşıcı madde için uygun etikete sahip bir nakliye paketinin diyagramıdır.
ŞEKIL 4. Tamamen etiketlenmiş bir dış ambalaj. İçerideki birincil kap, sıvı Kategori A bulaşıcı madde içerir ve PI 620'ye göre paketlenir.
Kısaltma: PI = paketleme talimatları.
Alternatif Metin: Şekil, sıvı Kategori A bulaşıcı bir madde için uygun etiketlemeye sahip bir nakliye paketinin diyagramıdır.
|
TABLO 17. Kalite sistemi temelleri (QSE), tanım ve ilgili biyogüvenlik hususları | |||
|---|---|---|---|
|
QSE no. |
QSE |
Tanım |
Biyogüvenlik hususları |
|
1 |
Organizasyon |
Sorumluluğun organizasyon yapısı tanımlanır. |
Güvenlik olaylarının 7/24 raporlanması için net raporlama yapısı oluşturulmuştur. Her personel, her zaman biyogüvenlik raporlaması için kime danışacağını bilir. Genel uyumluluk için bir sorumluluk zinciri, doğrudan organizasyon biriminin başkanına götürür. |
|
2 |
Belgeler ve kayıtlar |
İşlem ve prosedür belgeleri yazılır ve muhafaza edilir. |
Tüm olaylar ve "neredeyse ıskalar" kaydedilir. Tüm güvenlik uygulamaları ve politikaları yazılır, gözden geçirilir ve onaylanır ve tüm personel ve yönetime tüm vardiyalarda kullanılabilir. Belge denetimi, en güncel ilkelerin kullanımda ve kullanılabilir olmasını sağlar. Aşı kayıtları ve güvenlik eğitimi kayıtları uygun şekilde tamamlanır, korunur ve kolayca kurtarılır. |
|
3 |
Tesisler ve güvenlik |
Fiziksel çevre ve mekan yapılan işe uygundur. |
Tesisler güvenlik kontrolleri ile tasarlanmış ve inşa edilmiş ve yaralanma ve meslek hastalığı riskini en aza indirmiştir. Güvenli iş uygulamaları her zaman takip edilir. |
|
4 |
Personel |
Laboratuvar personeli, iş tanımlarına göre öngörülen politika ve prosedürleri takip eder. |
Personel oryantasyonda, yıllık olarak ve görevleri değiştiğinde uygun güvenlik eğitimi almıştır. Biyogüvenlik eğitimi ve sürekli eğitim belgeleri personel dosyalarında tutulur ve yıllık incelemeleriyle bağlantılıdır. Eğitim gereksinimleri yıllık kaynak planlama sürecinin bir parçasıdır. |
|
5 |
Ekipman |
Aletler ve ekipmanlar laboratuvar işlevlerini yerine getirmek için uygun şekilde kullanılır. |
İşletim cihazlarıyla ilişkili tüm biyolojik tehlike riskleri SOP'lerde açıkça tanımlanmıştır. Personel, bakımdan veya hizmet dışı kalmadan önce ekipmanı dekontamine etme prosedürlerinin farkındadır. |
|
6 |
Satın alma ve envanter |
Gerekli malzeme ve malzemelerin satın alınmasına ilişkin süreç ve prosedürlere uyulur. |
Uygun güvenlik malzemeleri (maskeler, eldivenler, önlükler, biyolojik tehlike imha çantaları ve konteynerleri) ve satıcılar tanımlanır ve belgelenir. Personelin kişisel güvenliklerinden veya başkalarının güvenliğinden ödün vermemesi için yeterli güvenlik malzemesi envanteri mevcuttur. |
|
7 |
Proses kontrolü |
İş akışı, müşteri beklentilerini karşılamak ve hizmet kalitesini sağlamak için tanımlanır. |
Operasyonel prosedürlerle ilişkili biyolojik tehlike riskleri açıkça tanımlanmış ve SOP'lerde referans verilmiştir. Düzenleyici standartlar karşılanır ve prosedürler öncelikli hedefler olarak kalite ve güvenlik ile haritalandırılır. |
|
8 |
Bilgi yönetimi |
Bilgi akışı etkilidir ve yasal ve düzenleyici gerekliliklere uygundur. |
Olayların ve yanıtların çalışana bildirilmesi belgelenmiştir. Belgelerin saklanması yasal gereklilikleri karşılar. |
|
9 |
Oluşum yönetimi |
Laboratuvar hatalarından veya diğer olaylardan kaynaklanan bilgiler tanımlanır ve analiz edilir. |
Yerleşik güvenlik prosedürleri ve politikalarına uyulmaması belgelenmiştir. Tüm olaylar Çalışan Sağlığına bildirilir; sistemlerin geliştirilebilmesi için tüm "neredeyse kayıplar" kaydedilir. Düzeltici eylemlerin oluşturulabilmesi için raporların hata türüne göre kategorize edilmesini sağlamak için bir raporlama mekanizması mevcuttur. |
|
10 |
Değerlendirme |
Sistemin etkinliği değerlendirilir. |
Gelişmiş yöntemler ve mühendislik kontrolleri başlatmak için biyogüvenlik riskleri ve politikalarının denetimleri yıllık olarak yapılır. |
|
11 |
Müşteri hizmetleri |
Müşterinin beklentileri karşılanır veya aşılır. |
Biyogüvenlik için gereklilikler karşılanır ve personel bunları korumak için politikalar, iş uygulamaları ve mühendislik kontrollerinden memnun kalır. Referans laboratuvarlarına ("müşteriler") gönderilen biyolojik numuneler, reaktifler ve diğer ürünler biyogüvenlik tehlikeleri açısından açıkça etiketlenmiştir. |
|
12 |
Süreç İyileştirme |
Süreçlerin sistemik incelemesi, iyileştirme alanlarını belirler. |
Risk ve müdahalelerin yanı sıra olay raporlarının sistematik olarak gözden geçirilmesi, sistematik iyileştirmeler için yönetim planlamasını bilgilendirir. |
|
Kısaltma: SOP = standart çalışma prosedürü. Kaynak: Klinik ve Laboratuvar Standartları Enstitüsü'nden uyarlanmıştır. Laboratuvar hizmetleri için bir kalite yönetim sistemi modelinin uygulanması; onaylı kılavuz—üçüncü baskı (CLSI belgesi GP26-A3) 2004 (222). |
|||




